В термодинамике выделяют несколько основных процессов. Термодинамическим процессом принято называть такое изменение общего состояния всей системы, когда в результате подобных трансформаций меняется полностью хотя бы один из ее основных параметров, его значение. Ими выступают:
Рисунок 1. Термодинамические процессы. Автор24 - интернет-биржа студенческих работ
- температура;
- давление;
- объем.
Известно, что все термодинамические процессы имеют тесные связи друг с другом. При изменении хотя бы одного параметра может меняться в неизбежном режиме вся система. В общем смысле, любой термодинамический процесс можно представить в виде равновесной системы, которая балансирует на грани нарушения этого равновесия. Если вся система уже находится в равновесном состоянии, то это явление не предполагает наличия термодинамических процессов вовсе. В таких системах не фиксируются термодинамические процессы.
Хоть понятие равновесного состояния системы нельзя назвать четким, все же существуют некоторые законы его присутствия в реальном воплощении. Любые материальные вещи невозможно полностью изолировать от окружающего его мира, поэтому в любой реальной системе возможно протекание различных термодинамических процессов. Иногда подобные процессы протекают настолько слабо и медленно, что не всегда удается их зафиксировать в оптимальном выражении. Специалисты их устанавливают как цепь разнообразных равновесных состояний системы. Их еще могут называть равновесными процессами, а также квазистатическими процессами.
Круговыми процессами и циклическими процессами называют ряд последовательных повторяющихся изменений в системе. В итоге система после прохождения определенного отрезка пути возвращается в исходное состояние. Круговой и равновесный процесс возникает и изучается под видом прикладных приемов термодинамики физических явлений, а также они лежат в основании некоторых теоретических размышлений и выводов науки.
Сегодня выделяют несколько основных термодинамических процессов:
- изобарный;
- изохорный;
- адиабатический;
- адиабатный;
- политропный;
- изотермический.
Изобарный процесс
Рисунок 2. Изобарный процесс . Автор24 - интернет-биржа студенческих работ
Определение 1
Изобарный процесс – это такой термодинамический процесс, который может протекать при постоянном давлении. Подобный процесс осуществляется, например, когда помещается газ в плотный цилиндр, где есть подвижный поршневой крючок.
На поршень действует постоянная внешняя сила. Она достигается при подводе или отводе теплоты к объекту. При этом сама подвижная часть поршня способна менять свое местоположение при изменении параметров температуры. От этого зависит направление движения поршня. Согласно закону Гей-Люссака, объем газа в нем меняется, исходя из уравнения закона. Из этого следует, что занимаемый объем газа может быть прямо пропорционален определенной температуре воздействия. Внутренняя энергия газов изменяется под действием температурного режима извне. Этим правилом характеризуется весь изобарный процесс в термодинамике.
Изохорный процесс
Определение 2
Изохорный процесс – термодинамический процесс, который заключается в протекании при постоянном объеме.
В качестве примера можно привести закрытый сосуд, куда помещен газ. При его нагревании возникают признаки изохорного процесса. При подводе особого температурного режима к изучаемому сосуду давление возрастает. Чем больше тепловой эффект, тем процесс становится более интенсивным. Подобные преобразования параметров газа в сосуде способен математическим методом описать закон Шарля.
Согласно его уравнению, давление газа на стенки сосуда будут прямо пропорциональными абсолютной температуре этого газа. Примечательно, что вся подведенная к сосуду теплота изменяет внутреннюю энергию газа, поэтому совершение работы не происходит изменение объема в сосуде при изохорном процессе равно нулевым значениям.
Адиабатный процесс
Адиабатный процесс - такой термодинамический процесс, который может протекать без теплообмена рабочего тела и окружающей среды. В обычных условиях адиабатный процесс сложно представить и осуществить, так как подобное явление протекает только с телом, помещенное в сосуд. В роли сосуда может находиться цилиндр с работающим поршнем внутри. Весь сосуд должен быть окружен теплоизоляционным материалом высокого качества. Однако полностью изолировать рабочее тело не представляется возможным и теплоизолятор сильного действия не даст гарантии обмена теплотой с окружающей средой. В этом случае, возможно, предстоит создать лишь приблизительную модель адиабатного процесса, так как многие явления протекают очень быстро и принято рассматривать подобные модели с показателями по погрешности.
Изотермический процесс
Изотермический процесс – термодинамический процесс, который протекает при неизменной температуре. Его так же, как и адиабатный процесс осуществить с точностью очень сложно. Для этого необходимо соблюдение условий по расширению и сжатию рабочего газа при постоянной температуре. Также нужно, чтобы газы успевали обмениваться с окружающей средой без потери собственного температурного режима. Хорошо способен описать этот процесс закон Бойля-Мариотта.
Политропный процесс
Политропный процесс характеризуется иными свойствами термодинамических процессов. В отличие от вышеперечисленных процессов термодинамики политропный процесс предполагает возможность изменения любого параметра газа. В других процессах подобные параметры изменять нельзя. Иные термодинамические процессы принято считать частными случаями политропного процесса.
Общим уравнением политропного процесса является $pvn = const$. В этом уравнении $n$ – показатель политропы, которая является постоянной для данного процесса величиной. Она принимает различные значения - ∞ до + ∞.
Если придавать известной формуле определенные значения показателю политропы, то в качестве результата получаем определенный термодинамический процесс. В зависимости от этих представлений приходит итог по изотермическому, адиабатному, изохорному или изобарному процессу.
В этой статье мы рассмотрим термодинамические процессы. Ознакомимся с их разновидностями и качественными характеристиками, а также изучим явление круговых процессов, обладающих в начальной и конечной точках одинаковыми параметрами.
Введение
Термодинамическими процессами называют явления, при которых происходит макроскопическое изменение термодинамики всей системе. Наличие разницы между исходным и конечным состоянием носит название элементарного процесса, но при этом необходимо, чтобы это различие было бесконечно малым. Область пространства, в границах которого протекает это явление, именуется рабочим телом.
По типу устойчивость можно различать равновесную и неравновесную. Равновесный механизм представляет собой процесс, в ходе которого все типы состояния, сквозь которые протекает система, относятся к равновесному состоянию. Реализация таких процессов происходит в случае, когда изменение протекает довольно медленно, или, другими словами, явление носит квазистатический характер.
Явление теплового типа можно разделить на обратимый и необратимый термодинамический процессы. К обратимым причисляют механизмы, при которых реализуется возможность проводить процесс в противоположное направление, при помощи одних и тех же промежуточных состояний.
Адиабатическая теплопередача
Адиабатическим путем теплообмена, является термодинамический процесс, происходящий в масштабах макромира. Еще одной характеристикой является отсутствие обмена теплом с пространством вокруг.
Широкомасштабные исследования в области данного процесса уходят стартом развития в начало восемнадцатого века.
Адиабатические типы процессов представляю собой частный случай политропной формы. Это обусловлено тем, что в таком виде равняется нулю, а значит, постоянная величина. Обратить подобный процесс можно лишь при наличии точки равновесия всех моментов во времени. Изменения в показателе энтропии не наблюдаются в таком случае либо протекают слишком медленно. Существует ряд авторов, признающих адиабатические процессы только в обратимых.
Термодинамический процесс газа идеального типа в форме адиабатического явления описывает уравнение Пуассона.
Изохорная система

Механизм изохорического типа - это термодинамический процесс, основанный на постоянной величине объема. Его можно наблюдать в газах или жидкостях, которые достаточно нагревали в сосуде, с неизменным объемом.
Термодинамический процесс идеального газа в изохорической форме, позволяет молекулам сохранять соответствие пропорций по отношению к температуре. Это обуславливается законом Шарля. Для реальных газов данная догма науки не применима.
Изобарная система
Изобарная система представлена в виде термодинамического процесса, который происходит при наличии постоянного давления снаружи. Протекание И.п. в достаточно медленном темпе, позволяющем давлению в пределах системы считаться постоянной и соответствующему показателю внешнего давления может считаться обратимым. Также к таким явлениям можно отнести случай, в котором изменение в выше упомянутом процессе, протекают с маленькой скоростью, позволяющей считать давление постоянным.
Осуществить И.п. можно в системе, подведенной (или отведенной) к теплоте dQ. Для этого необходимо произвести расширение работы Pdv и изменение внутреннего типа энергии dU, T.
- e.dQ, = Pdv+dU= TdS.
Изменения в уровне энтропии - dS, T - абсолютное значение температуры.
Термодинамические процессы идеальных газов в изобарной системе обуславливают наличие пропорциональности объема с температурой. Реальные газы определенное количество теплоты израсходует для внесения изменений в средний тип энергии. Работа такого явление равна показателю произведения давления извне, на изменения в объеме.

Изотермическое явление
Одним из основных термодинамических процессов является его изотермическая форма. Он происходит в физических системах, с постоянным показателем температуры.
Для реализации данного явления систему, как правило, переносят в термостат, с огромным показателем теплопроводности. Взаимный обмен тепла протекает с достаточной скоростью, чтобы обогнать скорость протекания самого процесса. Уровень температуры системы почти не имеет отличий от показателей термостата.
Осуществить процесс изотермической природы также можно с использованием тепловых стоков и (или) источников, проводя контроль постоянства температуры, используя термометры. Одним из самых распространенных примеров такого явления служит кипение жидкостей в условиях постоянного давления.

Изоэнтропийное явление
Изоэнтропийная форма тепловых процессов протекает в условиях постоянной величины энтропии. Механизмы тепловой природы можно получить, используя равенство Клаузиуса для обратимых процессов.
Только обратимые адиабатические процессы можно называть изоэнтропийными. Неравенство Клаузиуса утверждает, что необратимые типы тепловых явлений сюда относиться не могут. Однако постоянство энтропии можно наблюдать и при необратимом тепловом явлении, если работа в термодинамическом процессе над энтропией производится так, что она незамедлительно удаляется. Глядя на термодинамические диаграммы, линии, отображающие изоэнтропийные процессы, можно именовать как адиабаты или изоэнтропы. Чаще прибегают к первому названию, что вызвано отсутствием возможности корректно изображать линии на диаграмме, характеризующейпроцесс необратимого характера. Объяснение и дальнейшая эксплуатация изоэнтропийных процессов имеют огромное значение, так как часто применяется в достижении целей, практическом и теоретическом знании.
Изоэнтальпийный тип процесса

Изоэнтальпийный процесс - тепловое явление, наблюдаемое при наличии энтальпии в постоянной величине. Расчеты ее показателя делаются благодаря формуле: dH = dU + d(pV).
Энтальпией называют параметр, при помощи которого можно охарактеризовать систему, в которой изменения при возврате в обратное состояние самой системы не наблюдаются и, соответственно, равняются нулю.
Изоэнтальпийное явление теплообмена может на примере проявлять себя в термодинамическом процессе газов. Когда молекулы, например этана или бутана, «протискиваются» сквозь перегородку с пористым строением, а с теплом вокруг не наблюдается. Такое можно наблюдать в эффекте Джоуля-Томсона, применяемого в процессе получения сверхнизких показателей температуры. Изоэнтальпийные процессы являются ценными, в силу того, что дают возможность понижать температуру в рамках среды, не тратя для этого энергию.
Политропная форма
Характеристикой политропного процесса является его возможность изменять физические параметры системы, но оставлять показатель теплоемкости (C) в постоянной величине. Диаграммы, отображающие термодинамические процессы в такой форме, именуются политропными. Один из самых простых примеров обратимости отражается в идеальных газах и определяется при помощи уравнения: pV n = const. P - показатели давления, V - объемная величина газа.
«Кольцо» процесса

Термодинамические системы и процессы могут образовывать циклы, которые имеют круговую форму. Они всегда имеют идентичные показатели в начальном и конечном параметре, оценивающем состояние тела. К таким качественным характеристикам можно отнести наблюдение за показателями давления, энтропии, температуры и объема.
Термодинамический цикл находит себя в выражении модели процесса, протекающего в настоящих тепловых механизмах, превращающих тепло в работу механического типа.
Рабочее тело входит в состав компонентов каждой такой машины.
Обратимый термодинамический процесс представлен в виде цикла, который имеет пути проведения как в направлении прямо, так и обратно. Его положение залегает в системе замкнутого типа. Суммарный коэффициент системной энтропии при повторе каждого цикла не изменяется. У механизма, в котором теплопередача происходит только между нагревательным или холодильным аппаратом и рабочим телом, обратимость возможно только при цикле Карно.
Существует ряд других циклических явлений, которые могут обращаться лишь при достижении введения дополнительного резервуара с теплом. Такие источники называют регенераторами.

Анализ термодинамических процессов, в ходе которых происходит регенерация, показывает нам, что все они общие по циклу Рейтлингера. Доказано на ряде расчетов и экспериментов, что обратимый цикл обладает наибольшей степенью эффективности.
Термодинамический процесс (тепловой процесс) – изменение макроскопического состояния термодинамической системы. Если разница между начальным и конечным состояниями системы бесконечно мала, то такой процесс называют элементарным (инфинитезимальным).
Система, в которой идёт тепловой процесс, называется рабочим телом.
Тепловые процессы можно разделить на равновесные и неравновесные. Равновесным называется процесс, при котором все состояния, через которые проходит система, являются равновесными состояниями. Такой процесс приближённо реализуется в тех случаях, когда изменения происходят достаточно медленно, т. е. процесс является квазистатическим.
Тепловые процессы можно разделить на обратимые и необратимые. Обратимым называется процесс, который можно провести в противоположном направлении через все те же самые промежуточные состояния.
Виды тепловых процессов:
Адиабатный процесс - без теплообмена с окр. средой;
Изохорный процесс - происходящий при постоянном объёме;
Изобарный процесс - происходящий при постоянном давлении;
Изотермический процесс - происходящий при постоянной температуре;
Изоэнтропийный процесс - происходящий при постоянной энтропии;
Изоэнтальпийный процесс - происходящий при постоянной энтальпии;
Политропный процесс - происходящий при постоянной теплоёмкости.
Уравнение Менделеева-Клайперона (уравнение состояния идеального газа):
PV = nRT, где n – число молей газа, P – давление газа, V – объем газа, T – температура газа, R – универсальная газовая постоянная
Изопроцессы идеального газа. Их изображение в P - V диаграммах.
1) Изобарный процесс p = const, V/T = const



2) Изохорный процесс V = const, p/T = const



3) Изотермический процесс T = const, pV = const



Термодинамические процессы. Уравнение Менделеева-Клапейрона. Изопроцессы идеального газа. Их изображение на Р- V диаграммах.
Термодинамические процессы. Совокупность изменяющихся состояний рабочего тела называется термодинамическим процессом.
Идеальный газ - изучаемый в термодинамике воображаемый газ, у которого отсутствуют силы межмолекулярного притяжения н отталкивания, а сами молекулы представляют собой материальные точки, не имеющие объема. Многие реальные газы по своим физическим свойствам весьма близки к идеальному газу.
Основными процессами в термодинамике являются:
изохорный , протекающий при постоянном объеме;
изобарный , протекающий при постоянном давлении;
изотермический , происходящий при постоянной температуре;
адиабатный , при котором теплообмен с окружающей средой отсутствует;
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv =RT) следует:
p/T =R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p 2 /p 1 =T 2 /T 1 .
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при c v
q =c v (T 2 - T 1 ).
Т. к.l = 0, то на основании первого закона термодинамики Δu =q , а значит изменение внутренней энергии можно определить по формуле:
Δu =c v (T 2 - T 1 ).
Изменение энтропии в изохорном процессе определяется по формуле:
s 2 – s 1 = Δs = c v ln(p 2 /p 1 ) = c v ln(T 2 /T 1 ).
Изобарный процесс

Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
v / T =R / p =const
v 2 /v 1 =T 2 /T 1 ,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l =p (v 2 – v 1 ).
Т. к. pv 1 =RT 1 иpv 2 =RT 2 , то
l =R (T 2 – T 1 ).
Количество теплоты при c p = const определяется по формуле:
q =c p (T 2 – T 1 ).
Изменение энтропии будет равно:
s 2 – s 1 = Δs = c p ln(T 2 /T 1 ).
Изотермический процесс

При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
pv = RT = const
p 2 / p 1 =v 1 / v 2 ,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l =RT ln (v 2 – v 1 ) =RT ln (p 1 – p 2 ).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q =l.
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s 2 – s 1 = Δs =R ln(p 1 /p 2 ) =R ln(v 2 /v 1 ).
Адиабатный процесс

Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
du +p dv = 0
Δu +l = 0,
следовательно
Δu = -l.
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через c ад, и условие dq = 0 выразим следующим образом:
dq =c ад dT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (c ад = 0).
Известно, что
с p /c v =k
и уравнение кривой адиабатного процесса (адиабаты) в p, v -диаграмме имеет вид:
pv k = const.
В этом выражении k носит названиепоказателя адиабаты (так же ее называют коэффициентом Пуассона).
Значения показателя адиабаты k для некоторых газов:
k воздуха = 1,4
k перегретого пара = 1,3
k выхлопных газов ДВС = 1,33
k насыщенного влажного пара = 1,135
Из предыдущих формул следует:
l = - Δu = c v (T 1 – T 2 );
i 1 – i 2 = c p (T 1 – T 2 ).
Техническая работа адиабатного процесса (l техн) равна разности энтальпий начала и конца процесса (i 1 – i 2 ).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным . ВT, s -диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называетсяреальным адиабатным процессом .
Уравнение Менделеева-Клапейрона
Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных.
Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = n RT
где n – число молей газа;
P – давление газа (например, в атм ;
V – объем газа (в литрах);
T – температура газа (в кельвинах);
R – газовая постоянная (0,0821 л·атм /моль·K).
Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атм и температуре 26 о С. Вопрос: сколько молей O 2 содержится в колбе?
Из газового закона найдем искомое число молей n :
Не следует забывать преобразовывать температуру из градусов Цельсия в кельвины: (273 о С + 26 о С) = 299 K. Вообще говоря, чтобы не ошибиться в подобных вычислениях, нужно внимательно следить за размерностью величин, подставляемых в уравнение Клапейрона-Менделеева. Если давление дается в мм ртутного столба, то нужно перевести его в атмосферы, исходя из соотношения: 1атм = 760 мм рт. ст. Давление, заданное в паскалях (Па), также можно перевести в атмосферы, исходя из того, что 101325 Па = 1атм .
Билет 16
Вывод основного уравнения молекулярно-кинетической теории. Число степеней свободы молекулы. Закон распределения энергии по степеням свободы.
Вывод основного уравнения МКТ.



Число степеней свободы молекулы. Закон распределения энергии по степеням свободы.


Билет 17.
Первое начало термодинамики. Работа газа при изменении объема. Вычислить работу изотермического расширения газа.
Количество теплоты , полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. В циклическом процессе внутренняя энергия не изменяется.





Работа при изотермическом расширении газа вычисляется как площадь фигуры под графиком процесса.


Билет 18.
Теплоемкость идеального газа.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT).
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: C V – молярная теплоемкость в изохорном процессе (V = const) и C p – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
где R – универсальная газовая постоянная. При p = const
Таким образом, соотношение, выражающее связь между молярными теплоемкостями C p и C V , имеет вид (формула Майера):
|
C p = C V + R. |
Молярная теплоемкость C p газа в процессе с постоянным давлением всегда больше молярной теплоемкости C V в процессе с постоянным объемом
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ.
Билет 19.
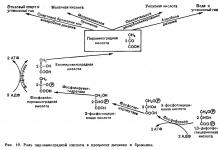
Цикл Карно. Тепловая и холодильная машины. КПД цикла Карно.
В термодинамике цикл Карно́ или процесс Карно - это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой - холодильником.
Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году.
Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно
Пусть тепловая машина состоит из нагревателя с температурой Тн, холодильника с температурой Тх и рабочего тела .
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две - при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура ) и S (энтропия ).
1. Изотермическое расширение (на рис. 1 - процесс A→Б). В начале процесса рабочее тело имеет температуру Тн, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q. При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 - процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника Тх, тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 - процесс В→Г). Рабочее тело, имеющее температуру Тн, приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты Q. Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 - процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Обратный цикл Карно
В термодинамике холодильных установок и тепловых насосов рассматривают обратный цикл Карно , состоящий из следующих стадии: адиабатического сжатия за счёт совершения работы (на рис. 1 - процесс В→Б); изотермического сжатия с передачей теплоты более нагретому тепловому резервуару (на рис. 1 - процесс Б→А); адиабатического расширения (на рис. 1 - процесс А→Г); изотермического расширения с отводом теплоты от более холодного теплового резервуара (на рис. 1 - процесс Г→В).


Билет 20.
Второе начало термодинамики. Энтропия. Третье начало термодинамики.
Второе начало термодинамики - физический принцип, накладывающий ограничение на направление процессов, которые могут происходить в термодинамических системах .
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода , показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Второе начало термодинамики является постулатом , не доказываемым в рамках классической термодинамики . Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Постулат Клаузиуса : «Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому» (такой процесс называется процессом Клаузиуса ).
Постулат Томсона (Кельвина) : «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона ).
Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии ).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
Третье начало термодинамики (теорема Нернста ) - физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю . Является одним из постулатов термодинамики , принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система» .
Третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение). Третье начало термодинамики может быть использовано для точного определения энтропии. При этом энтропию равновесной системы при абсолютном нуле температуры считают равной нулю.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики).
Термодинамическая энтропия S , часто просто именуемая энтропия , - физическая величина , используемая для описания термодинамической системы , одна из основных термодинамических величин . Энтропия является функцией состояния и широко используется в термодинамике , в том числе химической .


Лекция 2
ПДК выбрососв АЭС 0,05 Зв/год для персонала0,005Зв/год для населения вблизи
Термодинамическая система может произвести полезную работу только при условии, если в ней осуществляется термодинамический процесс. В этом случае изменяются и основные термодинамические параметры Р, v и Т. Термодинамический процесс - это совокупность изменений состояний термодинамической системы при её переходе из одного состояния в другое.
Мы будем рассматривать только равновесные термодинамические процессы , протекающие в равновесных системах. Равновесным состоянием системы называется состояние, когда во всех точках системы давления и температуры одинаковы. Система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Процесс, проходящий через чередующиеся равновесные состояния системы называется равновесным процессом .
В противном случае система неравновесна . Все процессы, протекающие в реальном времени, как правило, неравновесны. Допущение о существовании равновесных систем основано на том, что любая система, выведенная из состояния равновесия и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия называется релаксацией , а промежуток времени, в течение которого реальная система возвращается в состояние равновесия, называется временем релаксации . Если реальный процесс протекает медленнее, чем идёт релаксация, то процесс является равновесным. Дли разных процессов и разных параметров время релаксации различно. Внутренними процессами, компенсирующими нарушение равновесия при изменение состояния тела и восстанавливающими термодинамическое равновесие, являются элементарные процессы обмена энергией при столкновении молекул.
Интересно отметить, что превращение энергии поступательного движения молекул в энергию вращательного движения и обратно при столкновении молекул происходит весьма быстро. Так, давление в объёме выравнивается со скоростью звука (более 340 м/с в воздухе при нормальных физических условиях). Температура – значительно медленнее. Связано это с тем, что превращение энергии поступательного или вращательного движения молекул в колебательное при росте температуры осуществляется сравнительно медленно. Вообще все процессы обмена энергии, в которых участвуют колебательные степени свободы движения молекул, требуют для своего осуществления сравнительно большого времени.
Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным.
Теоретически равновесный процесс можно осуществить только при бесконечно медленном изменении состояний системы и внешних условий. В этом смысле время как действующий физический фактор в равновесных процессах не применяется.
Уравнение состояния F (Р, v,
Т) = 0 в трёхосной системе координат Р, v
и Т представляют собой поверхность, называемую термодинамической поверхностью
. Если рассечь эту поверхность (рис. 1.8) плоскостями параллельными осям координат, то получим кривые. Например, сечение плоскостью Т = const даёт линию изменения давления в зависимости от объёма в координатах Р и v
, Описываемый процесс называется изотермным.
В термодинамике чаще всего применяют двухосную систему с координатами Р и v
(рис. 1.9).
Термодинамика - наука, которая изучает тепловые явления, происходящие в телах, не связывая их с молекулярным строением вещества.
В термодинамике считается, что все тепловые процессы в телах характеризуются только лишь макроскопическими параметрами - давлением, объёмом и температурой. А так как их невозможно применить к отдельно взятым молекулам или атомам, то, в отличие от молекулярно-кинетической теории, в термодинамике молекулярное строение вещества в тепловых процессах не учитывается.
Все понятия термодинамики сформулированы как обобщение фактов, наблюдаемых в ходе экспериментов. Из-за этого её называют феноменологической (описательной) теорией тепла.
Термодинамические системы

Термодинамика описывает тепловые процессы, происходящие в макроскопических системах. Такие системы состоят из огромного количества частиц - молекул и атомов, и называются термодинамическими.
Термодинамической системой можно считать любой объект, который можно увидеть невооружённым глазом или с помощью микроскопов, телескопов и других оптических приборов. Главное, чтобы размеры системы в пространстве и время её существования позволяли провести измерения её параметров - температуры, давления, массы, химического состава элементов и др., с помощью приборов, не реагирующих на воздействие отдельных молекул (манометров, термометров и др.).
Для химиков термодинамическкой системой является смесь химических веществ, взаимодействующих между собой в процессе химической реакции. Астрофизики назовут такой системой небесное тело. Смесь горючего с воздухом в автомобильном двигателе, земной шар, наше тело, пишущая ручка, тетрадь, станок и др. - это также термодинамические системы.
Каждая термодинамическая система отделена от окружающей среды границами. Они могут быть реальными - стеклянные стенки пробирки с химическим веществом, корпус цилиндра в двигателе и т.п. А могут быть и условными, когда, например, изучают образование облака в атмосфере.
Если такая система не обменивается с внешней средой ни энергией, ни веществом, то её называют изолированной или замкнутой .
Если же система обменивается с внешней средой энергией, но не обменивается веществом, то она называется закрытой .
Открытая система обменивается с внешней средой и энергией, и веществом.
Термодинамическое равновесие

Это понятие также введено в термодинамику, как обобщение результатов экспериментов.
Термодинамическим равновесием называют такое состояние системы, при котором все её макроскопические величины - температура, давление, объём и энтропия - не изменяются во времени, если система является изолированной. В такое состояние может самопроизвольно перейти любая замкнутая термодинамическая система, если остаются постоянными все внешние параметры.
Самый простой пример системы в состоянии термодинамического равновесия - термос с горячим чаем. Температура в нём одинакова в любой точке жидкости. Хотя термос можно назвать изолированной системой лишь приблизительно.
Любая замкнутая термодинамическая система самопроизвольно стремится перейти в термодинамическое равновесие, если не меняются внешние параметры.
Термодинамический процесс

Если меняется хотя бы один из макроскопических параметров, то говорят, что в системе происходит термодинамический процесс . Такой процесс может возникнуть, если изменяются внешние параметры или система начинает получать или передавать энергию. В результате она переходит в другое состояние.
Вспомним пример с чаем в термосе. Если мы опустим в чай кусочек льда и закроем термос, то сразу же появится разница в температурах в разных частях жидкости. Жидкость в термосе будет стремиться к выравниванию температур. Из областей с более высокой температурой тепло будет передаваться туда, где температура ниже. То есть, будет происходить термодинамический процесс. В конце концов, температура чая в термосе снова станет одинаковой. Но она уже будет отличаться от первоначальной температуры. Состояние системы изменилось, так как изменилась её температура.
Термодинамический процесс происходит, когда ночью остывает песок, нагретый на пляже в жаркий день. К утру его температура понижается. Но как только взойдёт солнце, процесс нагревания начнётся снова.
Внутренняя энергия

Одно из главных понятий термодинамики - внутренняя энергия .
Все макроскопические тела обладают внутренней энергией, которая является суммой кинетических и потенциальных энергий всех частиц (атомов и молекул), из которых состоит тело. Эти частицы взаимодействуют только между собой и не взаимодействуют с частицами окружающей среды. Внутренняя энергия зависит от кинетической и потенциальной энергии частиц и не зависит от положения самого тела.
U = E k +E p
Внутренняя энергия изменяется с изменением температуры. Молекулярно-кинетическая теория объясняет это изменением скорости движения частиц вещества. Если температура тела растёт, то растёт и скорость движения частиц, расстояние между ними становится больше. Следовательно, увеличивается их кинетическая и потенциальная энергия. При понижении температуры происходит обратный процесс.
Для термодинамики важнее не величина внутренней энергии, а её изменение. А изменить внутреннюю энергию можно с помощью процесса теплопередачи или совершая механическую работу.
Изменение внутренней энергии механической работой

Бенджамин Румфорд
Внутреннюю энергию тела можно изменить, совершив над ней механическую работу. Если работа совершается над телом, то механическая энергия превращается во внутреннюю энергию. А если работу совершает тело, то его внутренняя энергия превращается в механическую.
Почти до конца XIX века считалось, что существует невесомое вещество - теплород, которое передаёт тепло от тела к телу. Чем больше теплорода втекает в тело, тем теплее оно будет, и наоборот.
Однако в 1798 г. англо-американский учёный граф Бенджамин Румфорд стал сомневаться в теории теплорода. Причиной тому были нагревания стволов пушек при сверлении. Он предположил, что причиной нагревания является механическая работа, которая совершается во время трения сверла о ствол.
И Румфорд провёл эксперимент. Чтобы увеличить силу трение, взяли тупое сверло, а сам ствол поместили в бочку с водой. К концу третьего часа сверления вода в бочке закипела. Это означало, что ствол получил тепло при совершении механической работы над ним.
Теплопередача

Теплопередачей называют физический процесс передачи тепловой энергии (теплоты) от одного тела к другому либо при непосредственном контакте, либо через разделяющую перегородку. Как правило, теплота передаётся от более тёплого тела к более холодному. Это процесс заканчивается, когда система приходит в состояние термодинамического равновесия.
Энергия, которую получает или отдаёт тело при теплопередаче, называется количеством теплоты .
По способу передачи теплоты теплообмен можно разделить на 3 вида: теплопроводность, конвенция, тепловое излучение.
Теплопроводность

Если между телами или частями тел существует температурная разница, то между ними будет происходить процесс теплопередачи. Теплопроводностью называют процесс переноса внутренней энергии от более нагретого тела (или его части) к менее нагретому телу (или его части).
К примеру, нагрев на огне один конец стального прута, через некоторое время мы почувствуем, что и другой его конец также становится тёплым.
Стеклянную палочку, один конец которой раскалён, мы легко держим за другой конец, не обжигаясь. Но если мы попробуем проделать такой же эксперимент с железным прутом, у нас ничего не получится.
Разные вещества по-разному проводят тепло. Каждое из них имеет свой коэффициент теплопроводности , или удельной проводимости , численно равный количеству теплоты, которая проходит через образец толщиной 1 м, площадью 1 м 2 за 1 секунду. За единицу температуры принимают 1 К.
Лучше всего проводят тепло металлы. Это их свойство мы используем в быту, готовя пищу в металлических кастрюлях или на сковородках. А вот их ручки не должны нагреваться. Поэтому их делают из материалов с плохой теплопроводностью.
Теплопроводность жидкостей меньше. А газы обладают слабой теплопроводностью.
Мех животных также плохо проводит тепло. Благодаря этому они не перегреваются в жаркую погоду и не замерзают в холодную.
Конвенция

При конвенции теплота передаётся струями и потоками газа или жидкости. В твёрдых телах конвенции нет.
Как возникает конвенция в жидкости? Когда мы ставим на огонь чайник с водой, нижний слой жидкости нагревается, его плотность уменьшается, он движется вверх. Его место занимает более холодный слой воды. Через какое-то время он тоже нагреется и тоже поменяется местами с более холодным слоем. И т.д.
Подобный процесс происходит и в газах. Не случайно батареи отопления размещают в нижней части комнаты. Ведь нагретый воздух всегда поднимается в верхнюю часть комнаты. А нижний, холодный, наоборот, опускается. Затем он нагревается также и вновь поднимается, а верхний слой за это время остывает и опускается.
Конвенция бывает естественная и принудительная.
Естественная конвенция постоянно происходит в атмосфере. В результате этого происходят постоянные перемещения тёплых воздушных масс вверх, а холодных - вниз. В результате возникает ветер, облака и другие природные явления.
Когда естественной конвенции недостаточно, применяю принудительную конвенцию. Например, потоки тёплого воздуха перемещают в комнате с помощью лопастей вентилятора.
Тепловое излучение

Солнце нагревает Землю. При этом не происходит ни теплопередачи, ни конвенции. Так почему же тела получают тепло?
Дело в том, что Солнце является источником теплового излучения.
Тепловое излучение - это электромагнитное излучение, возникающее за счёт внутренней энергии тела. Все окружающие нас тела излучают тепловую энергию. Это может быть видимое световое излучение настольной лампы, или источники невидимых ультрафиолетовых, инфракрасных или гамма-лучей.
Но тела не только излучают тепло. Они его также и поглощают. Одни в большей степени, другие в меньшей. Причём тёмные тела и нагреваются, и охлаждаются быстрее, чем светлые. В жаркую погоду мы стараемся надеть светлую одежду, потому что она поглощает меньше тепла, чем одежда тёмных тонов. Автомобиль тёмного цвета нагревается на солнце гораздо быстрее, чем стоящий с ним рядом автомобиль, имеющий светлую окраску.
Это свойство веществ по-разному поглощать и излучать тепло используется при создании систем ночного видения, систем самонаведения ракет на цель и др.