من المستحيل تحليل مشاكل الصلابة المفرطة للمياه الحديثة دون دراسة مفصلة للتنوع طرق لتليين الماء. وفرة المرشحات على أرفف المتاجر والأسواق تجعلنا نعتقد أن اختيار جهاز للشقة ليس بهذه البساطة. ومن أجل اختيار خيار المنقي المناسب، عليك أن تتعرف على الأقل أنواع مختلفةطرق لتليين الماء. دون معرفة الأساسيات، من المستحيل فهم الموضوع.
على الرغم من أننا نعرف الكثير عن الحجم، إلا أنه لا يزال هناك الكثير من التحيزات فيما يتعلق بأجهزة الترشيح، فضلاً عن الأساطير حول عدم جدواها، على الأقل بالنسبة للظروف المنزلية. تؤدي صلابة الماء المفرطة إلى عدد كبير من الظواهر غير المرغوب فيها. إن تكلفة تكوين القشور وضعف قابلية ذوبان أي منظفات في المياه القاسية منخفضة الجودة باهظة الثمن للغاية بحيث لا يمكن إهمال مشكلات تليين المياه اليوم.
لسبب ما، نعتقد أن العسر الزائد للمياه هو أسطورة، وأن استخدام المرشحات هو ضخ الأموال من المواطنين السذج. في الوقت نفسه، رأى الجميع ويعرفون جيدا ما هو الحجم ومدى صعوبة محاربته، ومدى صعوبة إزالته، باستمرار من شهر لآخر. إذا كانت لديك أي شكوك حول صلابة الماء لديك، فيمكنك دائمًا إجراء اختبار كيميائي للمياه. سيساعدك ذلك دائمًا ليس فقط على تحديد مدى نظافة المياه وصلاحيتها للأكل. بناء على نتائجها، يمكنك إنشاء الصحيح، أي المختصة.
ستعرف أنك تستخدم مياهًا منخفضة الجودة من خلال العديد من العلامات المألوفة لنا جميعًا. سوف تظهر الصلابة المفرطة حتى أثناء الطهي. يؤدي هذا الماء إلى أن يصبح اللحم أكثر صلابة. تتفكك الخضار عند طهيها في مثل هذا الماء. والحافة الأبدية لترسبات أملاح الصلابة. إذا كان لديك بالفعل مثل هذه الغلايات أو الأواني ذات الحافة الصلبة الأبدية على الأسطح، فإن مائة بالمائة من صلابة الماء لديك قد تجاوزت الحدود المسموح بها منذ فترة طويلة. حول التوفر مياه مماثلةفي الشقة، ستتعرف عليه ليس فقط من خلال رواسب الكلس داخل الغلاية، بل سيترك الماء بصماته حتى عند غسل الأطباق في غسالة الأطباق. يبدو أن النظارات والأطباق بعد الغسيل في مثل هذه الآلة يجب أن تخرج بشكل صارخ ونظيفة تمامًا، ولكن هذا ليس هو الحال مع الماء العسر. يمكن التعرف على استخدام مثل هذه المياه من خلال البقع البيضاء الواضحة على النظارات، والتي بالكاد يمكن ملاحظتها لوحة بيضاءعلى لوحات.
كما تؤثر القساوة على جودة الأطباق المحضرة والشاي والقهوة. القهوة الطبيعية الحقيقية المخمرة بالماء الجيد لها طعم مختلف تمامًا، وإذا كنت من محبي القهوة الحقيقيين، فإن مسألة إنشاء نظام إزالة الصلابة لن تزعجك أبدًا. عليك أن تحاول القهوة جيدةعلى الماء الصحيح.
تشير الملابس المغسولة بشكل سيء أيضًا إلى وجود أملاح الكالسيوم والمغنيسيوم الزائدة في الماء. إن تكوين القشور ليس كل ما ينتج عن العمل بمثل هذه المياه. كما أن لديها مثل هذه الميزة - مثل ضعف الذوبان في كل من المسحوق والصابون منظفللأطباق. لا توجد طريقة لتوفير المال عند العمل بالماء العسر. تؤدي هذه الميزة إلى التآكل السريع للأقمشة، فهي تبدأ في التصدع والتمزق حرفيا أمام أعيننا. ويستحق التثبيت من قبل غسالةسيتم حل منقي المياه الكهرومغناطيسي AquaShchit ومشكلة زيادة صلابة الماء. لكن يعتقد الكثير من الناس أن الجهاز الذي يحتوي على مغناطيس لا يمكنه تنظيف المياه. بينما هم على على سبيل المثالغير مقتنعين بكيفية عمل طرق تخفيف المياه بشكل عقلاني واقتصادي.
وهناك شيء آخر - إن استخدام المياه ذات الجودة المنخفضة للاستخدام الشخصي سيؤثر سلبًا في النهاية على صحتنا. لا يمكنك شرب مثل هذه المياه دون عقاب. وسوف يستجيب لك جسمك بطرق مختلفة. الأمراض المزمنةشيخوخة الجلد المبكرة وتساقط الشعر. ولكن لا يمكن لجميع الناس تحديد سبب هذه الأمراض على الفور من خلال صلابة المياه.
طرق تليين المياه تنطوي على الاستخدام أجهزة خاصة. مهمتهم هي إزالة اثنين من أملاح الكربونات الزائدة من الماء. ولكن هناك أيضًا طرقًا أكثر بدائية. لا يتم استخدامها أبدًا تقريبًا اليوم، ولكن قبل الاختراع، استخدمها أسلافنا في محاولة لحماية أنفسهم بطريقة ما من الآثار الضارة للكالسيوم والمغنيسيوم.
لذا بطريقة بسيطةتليين الماء هو استخدام قطعة بسيطة من السيليكون. كل ما تحتاجه للحصول على الماء العذب هو شراء قطعة من السيليكون بحجم 5 × 5 سم تقريبًا ووضعها في زجاجة (3 لتر) مع ماء الصنبور. في غضون أسبوع ستتمكن من شرب الماء "المشحون" ولن يكون متعفنًا بل ناعمًا ولذيذًا وأيضًا مع الخصائص الطبية. وهذا هو تأثير السيليكون على أملاح الكالسيوم والمغنيسيوم. في كثير من الأحيان في العصور القديمة كانت البئر مبطنة بالسيليكون للحصول على مياه جيدة.
اليوم، فإن استخدام طريقة السيليكون هذه لتليين المياه له الحق في الحياة، ولكن من غير المرجح أن يكون من الممكن تنقية كمية كبيرة من الماء بمساعدتها. لذلك، الطبية فقط الاستخدام الطبيمن هنا.
بالنسبة للصناعة، فإن استخدام الطرق البدائية لتليين المياه أمر مستحيل. في هذه الحالة، حتى استخدام نظام معالجة مياه مدروس بعناية يعتمد على التحليل الكيميائي للمياه لا يشكل حماية كاملة ضد تكوين القشور. لذلك، في هندسة الطاقة الحرارية، لا يزال يتعين عليك تنظيفها من الترسبات الكلسية. والفرق هو أنه بعد العمل، تتشكل اللوحة بشكل ضعيف، ولكنها تنمو بشكل أبطأ، والأهم من ذلك، يتم إزالتها بسهولة تامة. ليس عليك حتى الشراء تحته وسائل خاصة. الشطف المنتظم بالماء يكفي.
إن تكوين القشور، ليس أسوأ من ضعف الذوبان في الماء، يضر بالأجهزة والمعدات المنزلية. المشكلة هي أنه إذا لم تتم إزالة المقياس في الوقت المناسب، فإنه يبدأ في النمو بشكل أسرع وأكثر ثقة. وفي أعقابه، يبدأ التآكل في تطوير نشاطه ببطء. وهاتان الظاهرتان مرتبطتان بشكل لا ينفصم.
ليس المقياس قبيحًا وقبيحًا وقليل الفائدة فحسب، بل أيضًا مع تكوين المقياس، يزداد خطر فقدان المعدات والمعدات باهظة الثمن. دائمًا ما تكون المشكلات المتعلقة بالحجم، خاصة في الصناعة، بمثابة تكلفة كبيرة جدًا. طرق تليين المياه. لا يمكن أن يظهر كل من الكاشف وغير الكاشف بهذه الطريقة. وكان لابد من وجود أسباب وجيهة لإنشائها. هذا هو سبب الحجم.
في بيوت الغلايات، وخاصة البخارية، إنها قصة كاملة. لكي تعمل غرفة الغلايات البخارية، يجب أن تكون جودة البخار عالية جدًا وخلال فترة التنقية، يمر كل من الماء والبخار بعدد كبير من الحالات، مما يساعد محطات توليد الطاقة البخارية على الاستمرار لفترة أطول بكثير مما كانت عليه عند العمل مع المياه غير المعالجة.
ما الذي يؤدي إليه الماء السيئ؟ يتم تسخينها. أثناء عملية التسخين، تشكل أملاح الصلابة راسبًا سيئ الذوبان، أي مقياس، والذي عند تسخينه يستقر بدقة على السطح الساخن. الطبقة المتكونة، على الرغم من تشكلها أثناء عملية التسخين، إلا أنها لا تمتص الحرارة أو تنقلها من تلقاء نفسها. ونتذكر أنه تم ترسيبه على سطح التسخين. بمرور الوقت، تصل كثافة طبقة المقياس إلى هذه الحدود التي تتوقف فيها الحرارة تماما عن الانتقال إلى الماء.
خلال هذه الفترة الزمنية، يزداد استهلاك الوقود بشكل لا يمكن تصوره. بعد كل شيء، الجهاز أو المعدات تحاول العمل. ووظيفتهم تسخين الماء. وللقيام بذلك، عليك أن تحاول تسخين المقياس بحيث ينقل ما لا يقل عن 10 في المائة من الحرارة المنقولة إليه إلى الماء. للقيام بذلك عليك أن تنفق الكثير من الوقود. يستغرق هذا الكثير من الوقت وتعاني الأسطح من أحمال زائدة هائلة. وبطبيعة الحال، لا يمكن أن يستمر هذا إلى الأبد. تدخل المعادن، كما كانت، إلى فرن مفتوح إذا كانت مغطاة بطبقة من الحجم.
لذلك اتضح أن الأجهزة المنزلية يمكن أن تنطفئ حتى لا تحترق، لكن غلاية الوقود الصلب لا يمكنها القيام بذلك. لا يمكن تمزيقه إلا بمثل هذا التأثير. وهنا من الممكن وقوع خسائر بشرية. لذلك، من الضروري التعامل مع هذا بشكل صحيح للغاية وبعناية. من المستحيل تمامًا تخطي عملية إزالة الترسبات الكلسية، خاصة في الصناعة.
أي إزالة الترسبات من المعدات الصناعية يعني إيقاف تشغيل إلزامي للنظام. هذا هو وقت التوقف عن العمل، وهذا مرة أخرى منتجات لم يتم تسليمها في الوقت المحدد، وهذه نفقات. لا يمكن إزالة الترسبات الكلسية من الجهاز أثناء تشغيله. توقف ونظف فقط. وفي أغلب الأحيان، التنظيف قابل للفك، لأن... المعدات، سواء في بيوت الغلايات أو في علم المعادن، معقدة. لن يكون من الممكن الوصول إلى الأماكن النائية على الفور. لذا فكر فيما إذا كانت عملية الإزالة رخيصة جدًا حقًا. أطقم تركيب المعدات، أطقم تنظيف الأسطح، التوقف، الدفع مقابل منتجات التنظيف. بالتأكيد لن تتمكن من توفير المال عند إزالة الترسبات.
وبغض النظر عن مدى صعوبة محاولتك، فلن تتمكن بالتأكيد من إجراء أي تنظيف مضاد للتكلس دون ترك أي أثر. ستكون هناك دائمًا خدوش، ولا يزيل التنظيف الميكانيكي الطبقة الواقية فحسب، بل سيؤثر أيضًا على الطبقة الأساسية. حسنًا، أي سطح تالف هو المكان المفضل لترسبات الحجم. لذلك اتضح أنه من خلال إزالة مقياس واحد، فإننا نحفز التكوين السريع للطبقات الأخرى. لذلك، ليس من المربح إزالة النطاق باستمرار، وليس مربحا على الإطلاق.
 الآن فيما يتعلق بطرق تليين الماء العسر. على الرغم من أنه قد يبدو للوهلة الأولى أن هناك العديد من أجهزة التليين، إلا أنه لا توجد طرق كثيرة لتليين الماء العسر، على الرغم من وجود خيار. يمكن تقسيم الطرق بأمان إلى كيميائية وفيزيائية. تتضمن تنقية المياه الكيميائية استخدام الكواشف المختلفة، حيث تصبح أملاح الصلابة ضعيفة الذوبان، وتترسب ويتم إزالتها بسهولة من الأنظمة التي يتم فيها استخدام الماء. دعونا نتعلم المزيد عن هذه الطرق لتليين الماء العسر. أنواعها ومزاياها.
الآن فيما يتعلق بطرق تليين الماء العسر. على الرغم من أنه قد يبدو للوهلة الأولى أن هناك العديد من أجهزة التليين، إلا أنه لا توجد طرق كثيرة لتليين الماء العسر، على الرغم من وجود خيار. يمكن تقسيم الطرق بأمان إلى كيميائية وفيزيائية. تتضمن تنقية المياه الكيميائية استخدام الكواشف المختلفة، حيث تصبح أملاح الصلابة ضعيفة الذوبان، وتترسب ويتم إزالتها بسهولة من الأنظمة التي يتم فيها استخدام الماء. دعونا نتعلم المزيد عن هذه الطرق لتليين الماء العسر. أنواعها ومزاياها.
الطرق الفيزيائية لتليين المياه
المجموعة الطرق الفيزيائيةتليين المياهيعمل بدون استخدام أي مواد كيميائية. هذه المجموعة مثالية لتنقية مياه الصنبور، أي المياه التي تستخدم أيضًا للاستخدام الشخصي - للشرب والأكل. يجب أن تكون المياه هناك ناعمة بشكل افتراضي.
طرق الغشاء لتليين المياه
 يمكنك أيضًا تحديد مجموعة طرق الغشاء لتليين المياه. وهذا يشمل التناضح العكسي، الذي يحظى بشعبية كبيرة في الصناعة. هذه طريقة تنظيف جيدة باستخدام الضغط. يوجد داخل مثل هذا الجهاز غشاء رقيق مصنوع من مواد باهظة الثمن. كامل سطح هذا الغشاء مليء بالثقوب. ولا يتجاوز قطر هذه الثقوب حجم جزيء الماء. مثل هذا السطح شبه المنفذ يجعل من الممكن إزالة أي شوائب من الماء تقريبًا أكبر من جزيء الماء.
يمكنك أيضًا تحديد مجموعة طرق الغشاء لتليين المياه. وهذا يشمل التناضح العكسي، الذي يحظى بشعبية كبيرة في الصناعة. هذه طريقة تنظيف جيدة باستخدام الضغط. يوجد داخل مثل هذا الجهاز غشاء رقيق مصنوع من مواد باهظة الثمن. كامل سطح هذا الغشاء مليء بالثقوب. ولا يتجاوز قطر هذه الثقوب حجم جزيء الماء. مثل هذا السطح شبه المنفذ يجعل من الممكن إزالة أي شوائب من الماء تقريبًا أكبر من جزيء الماء.
باستخدام هذا الجهاز، يمكنك بسهولة الحصول على مياه مثالية لنفس الصيدلة أو لإنتاج مياه الشرب. يتم الحصول على نواتج التقطير باستخدام الترشيح النانوي. وهذا نوع آخر التناضح العكسي، الضغط المنخفض فقط.
والميزة الرئيسية لهذه الطريقة لتليين المياه هي أعلى درجة من التنقية، والقدرة على الحصول على الماء بالخصائص المحددة فقط عن طريق تغيير الغشاء. لكن التناضح العكسي، مثل الطرق الغشائية الأخرى لتنقية المياه، له عيوبه. أثناء تشغيل الجهاز، يوجد الكثير من الماء داخل الجهاز. يحدث هذا لعدة أسباب. أولًا، معدل النفاذ خلال الغشاء ليس مرتفعًا تقريبًا، بالإضافة إلى أن الجهاز يحتوي على أكثر من مرشح. قد يشمل التثبيت التناضح العكسي، ومرشح ميكانيكي وتكييف الهواء. هذا الأخير مطلوب ليتم تركيبه في منشآت إنتاج مياه الشرب. تعمل هذه الطريقة لتحلية المياه بشكل جيد للغاية على إزالة أي شوائب، بما في ذلك البكتيريا والفيروسات، وهو أمر مهم لمياه الشرب. ثم، بدون تكييف، تصبح هذه المياه غير صالحة للاستخدام الشخصي. حسنا، فإن استخدام التناضح العكسي يحد بشكل كبير من تكلفة التثبيت. لا يستطيع الجميع في الحياة اليومية استخدام مثل هذا التثبيت.
الطريقة الكيميائية لتليين المياه
الطريقة الكيميائية لتليين المياهكما قلنا من قبل، يعني الاستخدام المواد الكيميائية. وهذا يشمل كلور الصوديوم والفوسفات. لمثل هذا التليين، غالبا ما تستخدم الموزعات، والتي يتم تركيبها على أنابيب المياه. مثل هذه الأساليب سيئة لأن المواد الكيميائية يمكن أن تشكل شوائب أخرى في الماء ويتم الحصول على نفس الرواسب. فقط من الصعب جدًا التخلص منه. وفي الوقت نفسه، تتضمن الطريقة الكيميائية لتليين المياه أيضًا الترميم الكيميائي لأجزاء المرشح في الأجهزة. ولذلك فإن أشهر هذه الطريقة هو التبادل الأيوني. هنا يتم تجديد الخرطوشة باستخدام محلول مالح جدًا. بعد الاستعادة، ستكون الخرطوشة قادرة على العمل مرة أخرى.
طريقة التبادل الأيوني لتليين المياه
التبادل الأيوني، باعتبارها وسيلة لتليين المياه هي واحدة من أبسط الطرق. لا يتطلب أي هياكل خاصة. الأساس، كما يوحي الاسم، هو التبادل الأيوني. يعمل الراتنج الشبيه بالهلام داخل مثل هذا الجهاز. يحتوي على كمية كبيرة من الصوديوم، والتي يتم استبدالها بسرعة كبيرة عند ملامستها للماء العسر ببلورات أملاح الكالسيوم والمغنيسيوم. وينتج عن ذلك عملية تنظيف بسيطة وسريعة، دون أي جهد. بعد فترة زمنية معينة، يتم غسل كل الصوديوم الموجود في الخرطوشة.
في الصناعة، تتم استعادة الخرطوشة عن طريق غسلها بمحلول، ولكن في الحياة اليومية يتم استبدالها ببساطة، لأن مياه الشرب لا تتسامح مع الكواشف. سرعة التنظيف ممتازة، ولكن تكلفة الخراطيش أو ترميمها مرتفعة جدًا. وفي الحياة اليومية، يمكن لإبريق الفلتر تنظيف بضعة لترات على الأكثر. للحصول على الحماية الكاملة ضد الحجم والصلابة، سيتعين عليك استخدام مرشح آخر.
طريقة خالية من الكواشف لتليين المياه
ممثل مشرق طريقة خالية من الكواشف لتليين المياههو تأثير القوة المغناطيسية. أساس هذه الأجهزة هي مغناطيسات قوية. بالتأكيد دائمة. أنت تقوم فقط بتثبيت مثل هذا الجهاز، ولكن المجال المغناطيسي يعمل بالفعل. الجهاز سهل التركيب وسهل الإزالة. لا يحتاج إلى صيانة، ولا يحتاج إلى خراطيش أو تنظيف. هو يعمل. وهكذا يتخلل مجال القوة المغناطيسية الماء بحيث تفقد أملاح الصلابة الموجودة فيه شكلها السابق. الآن هذه إبر حادة. إنهم يقومون بفرك الأسطح بالقشور القديمة، ويزيلونها بكفاءة عالية. لكن التأثير المغناطيسي صعب الإرضاء للغاية فيما يتعلق بالمياه. فهو يحتاج إلى ماء بدرجة حرارة الغرفة، يتدفق في اتجاه واحد وبسرعة معينة. كان من الممكن إزالة جميع عيوب الطريقة المغناطيسية لتليين الماء فقط عن طريق الإضافة التيار الكهربائي. هكذا تم اختراع الجهاز الكهرومغناطيسي.
بعد التعرف على الجميع طرق لتليين الماءيجب أن نستنتج أن رفض التخفيف اليوم يعني المخاطرة بصحة عائلتك والافتقار التام إلى البصيرة. ولذلك، يختار المزيد والمزيد من الناس اليوم هذا الطريق.
تليين المياه
يتم إنتاجه بشكل رئيسي في تحضير المياه للأغراض التقنية. يتم تحديد اختيار طريقة معالجة المياه حسب جودتها وعمق المعالجة المطلوب والاعتبارات الفنية والاقتصادية. وفقًا لـ SNiP للتليين المياه الجوفيةوينبغي استخدام طرق التبادل الأيوني؛ لتليين المياه السطحية، عندما تكون تصفية المياه مطلوبة أيضًا، يتم استخدام طريقة الجير أو صودا الجير، ولتليين المياه بعمق، يتم استخدام الكاتيون اللاحق. يتم استخدام الطريقة الحرارية لتليين المياه عند استخدام المياه الكربونية لتغذية الغلايات ضغط منخفض. طريقة الجير - لإزالة جزئية للكربونات والصلابة غير الكربونية من الماء. تعتمد طريقة التبادل الكاتيوني لتليين الماء على قدرة مبادلات الكاتيونات على تبادل المجموعات النشطة من الكاتيونات (الصوديوم والهيدروجين) لكاتيونات الكالسيوم أو المغنيسيوم في الماء.
تسمى العملية التي تؤدي إلى انخفاض صلابة الماء بالتليين. . يأتي التليين من خلال تقليل تركيز أملاح الكالسيوم والمغنيسيوم في الماء. الأساليب الموجودةيمكن تقسيم التليين إلى ثلاث مجموعات: طرق الكاشف لتليين المياه، وتليين المياه بطريقة التبادل الأيوني، وتليين المياه الحرارية.
غالبًا ما يتم الجمع بين هذه الطرق: فهي تجمع بين طرق الكاشف وطريقة التبادل الأيوني، والطرق الحرارية مع طرق الكاشف.
يتم عرض الطرق الحالية لتليين المياه في الجدول. 3.1.
الجدول 3.1
| طرق تليين المياه | شروط على نحو فعالتليين المياه | |||
| مصدر تعكر المياه، ملغم/لتر | إجمالي عسر مياه المصدر، مكافئ/لتر | حد التخفيض المحتمل في الصلابة، mEq/l | مصدر درجة حرارة الماء درجة مئوية | |
| الكاشف (الجير والصودا) | ما يصل إلى 400−500 | 5−35 | 1. بدون تسخين المياه 0.5−1 2. مع تسخين المياه 0.2−0.4 | على الأقل 10−20 نفس الشيء، 80−90 |
| كاتيونيت نا-كاتيون مرحلة واحدة نا-كاتيون مرحلتين | لا يزيد عن 5−8 5-8 | ما يصل إلى 15 من 8−10 إلى 14 | 0.03−0.005 حتى 0.01 | عند تحميل المرشحات بالكربون المسلفن: 30−40 للمياه القلوية قليلاً و60 للمياه المحايدة والحمضية قليلاً |
| H−Na الموجبة | 5-8 | حتى 14 | 0,03 | عند تحميل المرشحات بفحم السلفو 30─40 |
| الحرارية | لا يزيد عن 50 | صلابة كربونات مع غلبة أملاح الكالسيوم (HCO 3) 2 صلابة غير كربوناتية فقط على شكل جبس | صلابة الكربونات تصل إلى 0.035 والجبس حتى 1200 نفس الجبس حتى 40−50 | 105−120 200−270 |
تليين الماء بالصودا الكاوية.تربط الصودا الكاوية كاتيونات الكالسيوم والمغنيسيوم وفقا للمعادلات:
Ca (HCO 3) 2 + 2NaOH CaCO 3 ↓ + Na 2 CO 3 + 2H 2 O؛
ملغ (HCO 3) 2 + 4NaOH Mg (OH) 2 ↓ + 2Na 2 CO 3 + 2H 2 O.
تتفاعل الصودا الناتجة مع الصلابة غير الكربونية وتزيلها جزئيًا من الماء: CaSO 4 + Na 2 CO 3 CaCO 3 ↓ + Na 2 SO 4 .
وبالتالي فإن الصودا الكاوية تزيل الصلابة الكربونية وغير الكربونية بكمية تعادل كربونات الصوديوم الناتجة.
تليين المياه بأملاح الباريوم.تشبه هذه الطريقة طريقة الصودا الليمونية، ولكنها تتمتع بميزة أن المنتجات المتكونة أثناء التفاعل غير قابلة للذوبان في الماء. باستخدام هذه الطريقة، يتم تقليل محتوى الأملاح التي تسبب عسر الماء، ويصبح التليين أكثر اكتمالاً. بالإضافة إلى ذلك، فإن عدم ذوبان BaCO 3 لا يتطلب جرعات صارمة، ويمكن أن تتم العملية تلقائيًا.
يمكن تمثيل التفاعلات التي تحدث أثناء التليين بمركبات الباريوم من خلال المخططات التالية:
1) CaSO 4 + Ba (OH) 2 ® Ca (OH) 2 + BaSO 4 ↓؛
2) MgSO 4 + Ba (OH) 2 ® Mg (OH) 2 ↓ + BaS0 4 ↓؛
3) Ca (HCO 3) 2 + Ba (OH) 2 ® CaCO 3 ↓ + BaCO 3 ↓ + 2H 2 O؛
4) ملغ (HC0 3) 2 + 2Ba (OH) 2 ® 2BaCO 3 ↓ + Mg (OH) 2 ↓ + 2H 2 O؛
5) BaCO 3 + CaSO 4 ® BaSO 4 ↓ + CaCO 3 ↓ ؛
6) Ca (OH) 2 + Ca (HCO 3) 2 ® 2CaCO 3 ↓ + 2H 2 O.
عند التليين بأملاح الباريوم، لا تؤدي التفاعلات إلى استبدال ملح بآخر، بل إلى إزالتها بالكامل من الماء؛ وهذه هي ميزة التليين بأملاح الباريوم. تشمل عيوب هذه الطريقة ارتفاع تكلفة أملاح الباريوم وبطء التفاعل مع كربونات الباريوم BaCO 3 .
تليين المياه بطريقة التبادل الأيوني. تسمى المواد القادرة على تبادل الامتصاص للأيونات مع محلول إلكتروليت المبادلات الأيونية.
المبادلات الأيونية عبارة عن مواد حبيبية صلبة تنتفخ في الماء ولكنها غير قابلة للذوبان فيه. بناءً على تكوين الهيكل العظمي الرئيسي، الذي يربط المجموعات الأيونية معًا، تنقسم مواد ماصة التبادل الأيوني إلى: 1) معدنية و2) عضوية.
المبادلات الأيونية المستخدمة في تنقية المياه هي من أصل طبيعي وصناعي. مثال على الأول يمكن أن يكون فحم الجلوكونيت والدبال، ومثال على الأخير يمكن أن يكون الفحم المسلفنة وراتنجات التبادل الأيوني الاصطناعية.
راتنجات التبادل الأيوني عبارة عن بوليمرات شبكية ثلاثية الأبعاد لا تذوب في الماء، بل تنتفخ فيه بدرجة محدودة وتحتوي على مجموعات أيونية، أي مجموعات قادرة على تبادل الأيونات. عدد وطول الجسور المتصلة الدوائر الخطيةالبوليمر، يحدد "كثافة" الشبكة، والتي لها تأثير قوي على خصائص المبادلات الأيونية.
وتنقسم الأيونات إلى مبادلات الكاتيونو مبادلات أنيونية.تسمى المواد التي تتبادل الكاتيونات بمبادلات الكاتيونات، وتسمى المواد التي تتبادل الأنيونات بمبادلات الأنيونات.
تنفصل مبادلات الكاتيون إلى كاتيونات صغيرة ومتحركة وقادرة على التبادل الأيوني (على سبيل المثال، H +) وأنيون عالي الوزن الجزيئي (R m -1)، وتعطي مبادلات الأيونات أنيونات صغيرة وسهلة الحركة (على سبيل المثال، OH -) و كاتيون عالي الوزن الجزيئي (R n +).
تقليديًا، يمكن تمثيل تفككهم بالشكل التالي:
Н م R = mH + + R م – ; R(OH) ن = R ن + + نوه – ،
حيث m و n هما عدد الأيونات المتنقلة في مبادل الكاتيون ومبادل الأنيون.
من بين راتنجات التبادل الكاتيوني، الأكثر استخدامًا هي الراتنجات التي تتكون من التكثيف المتعدد للفينول والفورمالدهيد، وكذلك البوليمرات - منتجات بلمرة الستايرين المشتركة مع هيدروكربونات ديين.
من بين مبادلات أنيون الراتينج، يتم استخدام مبادلات أنيون أمينو فورمالديهايد ومبادلات أنيون البوليسترين، وهي منتجات الإضافة من المجموعات الرئيسية إلى بوليمرات البوليسترين المشتركة، في أغلب الأحيان.
يمكن أن تحتوي جميع المبادلات الأيونية على نفس المجموعات الأيونية أو مختلفة. تم العثور على مبادلات كاتيونية ذات مجموعات وظيفية مختلطة في التركيبة التالية: 1) حمض السلفونيك والأوكسيفينول؛ 2) حمض السلفونيك والكربوكسيل. 3) بقايا حمض الفوسفوريك والهيدروكسيفينوليك؛ 4) حمض الزرنيخ والهيدروكسيفينوليك. 5) الكربوكسيل والأوكسيفينوليك.
حسب درجة التفكك تنقسم المبادلات الأيونية إلى: 1) حمضية قوية و 2) حمضية ضعيفة. 3) أساسي بقوة و 4) أساسي ضعيف.
تتفاعل مبادلات الكاتيون الحمضية القوية مع الأملاح الذائبة في الماء في الوسائط المحايدة والحمضية. تقوم مبادلات الكاتيونات الحمضية الضعيفة التي تحتوي على مجموعات الكربوكسيل أو الأوكسيفينول بتبادل البروتون في المحاليل المحايدة فقط لأملاح التبادل الكاتيوني الأحماض الضعيفةويزداد اكتمال التبادل مع زيادة الرقم الهيدروجيني للبيئة.
تتفاعل المبادلات الأنيونية القوية مع المحاليل الملحية في بيئة محايدة وحتى قلوية قليلاً. تدخل مبادلات الأنيونات الأساسية الضعيفة في تفاعل التبادل فقط في البيئات الحمضية، ويزداد اكتمال تبادل مجموعة الهيدروكسيل في مبادل الأنيون لأنيون المنحل بالكهرباء مع زيادة حموضة البيئة. تتأثر قوة المجموعات الأيونية بشكل كبير بالمجموعات الوظيفية الأخرى المرتبطة بها بشكل مباشر.
وبالتالي، فإن معظم مبادلات الكاتيون هي أحماض بوليمرية متعددة الوظائف، والتي تشمل المجموعات –COOH، –SO3H، –OH، –SH، SiOOH، إلخ.
مبادلات أنيونيةهي مركبات عالية الجزيئات تحتوي على عدد كبير من المجموعات الأساسية، مثل –NH 2، –NH 3 OH، –NHR، –NR 2، إلخ. قد يتضمن تكوين نفس المبادل الأيوني مجموعات أيونية بدرجات متفاوتة من الحموضة و القلوية.
ولأغراض التصفية، يحاولون الحصول على الراتينج في شكل جزيئات كروية عن طريق بلمرة التعليق أو خلط الراتينج المنصهر، ولكن "غير المتشابك" في مذيب خامل، يليه التبريد. تخلق المبادلات الأيونية (في مثل هذا الشكل السائب) ظروفًا مواتية لحركة السائل المفلتر.
تعتمد عملية التبادل على تفاعل كيميائي يحدث في الخارج و السطح الداخليالأيونيين. يحدث تبادل الأيونات بكميات متكافئة تمامًا.
تحدث تفاعلات التبادل في المحلول على الفور تقريبًا، لكن عمليات التبادل الأيوني مع المبادلات الأيونية التي تحدث في بيئة غير متجانسة لها سرعة قابلة للقياس تمامًا. في الواقع، يتم تحديد المعدل المرصود بواسطة معدل الانتشار، وهو أبطأ خطوة في التبادل الأيوني. في هذه الحالة، ينخفض معدل التبادل الأيوني مع زيادة حجم حبيبات المبادل الأيوني.
يتم تبادل الأيونات في المحاليل بشكل انتقائي. مع انخفاض التركيز المطلق للمحلول، يتم امتصاص الأيونات متعددة التكافؤ بشكل أفضل من الأيونات أحادية التكافؤ، وعندما تركيزات عاليةيتم امتصاص أيون أحادي التكافؤ. على سبيل المثال، عند تليين الماء، يتم امتصاص أيونات Ca 2+ وMg 2+ بشكل انتقائي، في حين لا يتم امتصاص أيونات Na+ عمليًا. عند معالجتها بمحلول كلوريد الصوديوم المركز، يتم إزاحة أيونات الفلز ثنائي التكافؤ من المبادل الكاتيوني بواسطة أيونات الصوديوم. يتم استخدام هذا عند تجديد مرشح التبادل الكاتيوني.
السمة التكنولوجية الرئيسية للمبادلات الأيونية هي القدرة التبادلية، والذي يتم تحديده من خلال عدد الأيونات المستخرجة من الماء بواسطة 1 جرام من المبادل الأيوني المجفف بالهواء.
في ممارسة تنقية المياه، غالبًا ما يتم استخدام مبادلات H- وNa-caten. اعتمادًا على الكاتيون، تُسمى هذه العملية بـ H-cationization وNa-cationization. مع كاتيون الهيدروجين، تزداد حموضة الماء، ومع كاتيون الصوديوم، تزداد قلوية المرشح إذا كان مصدر الماء يحتوي على صلابة كربونات.
تجدر الإشارة إلى أن معدل التبادل الأيوني أثناء عملية الكاتيون يعتمد على عوامل كثيرة، على سبيل المثال، تكافؤ الأيونات، وشحنتها، وكمية الماء، ونصف القطر الفعال للأيون. بناءً على معدل دخول الأيونات إلى المبادل الكاتيوني، يتم ترتيبها في الصف التنازلي التالي: Fe 3 +>Al 3 +>Ca 2 +>Mg 2 +>Ba 2 +>NH 4 + >K + >Na+. يمكن تغيير هذا النمط عن طريق زيادة تركيز الأيونات أثناء تجديد مرشحات التبادل الكاتيوني عند معالجتها بمحلول مركز من كلوريد الصوديوم.
مرشح المبادل الكاتيوني عبارة عن خزان أسطواني من الفولاذ يبلغ قطره من 1 إلى 3 أمتار، حيث يتم وضع طبقة من المبادل الكاتيوني على جهاز الصرف. ارتفاع طبقة الفلتر 2...4 م سرعة الترشيح من 4 إلى 25 م/ساعة. تم تصميم المرشحات لضغوط التشغيل حتى 6 أجهزة الصراف الآلي.
يعمل مرشح المبادل الكاتيوني على المراحل التالية:
الترشيح من خلال المرشح المجهز حتى يتم تشبع القدرة التبادلية للمبادل الكاتيوني؛
تخفيف المبادل الكاتيوني بتدفق تصاعدي؛
تجديد المرشح بمحلول NaCl (مع Na-cationization)؛
غسل الحمولة من الكميات الزائدة من المادة المتجددة.
يستمر تجديد الأحمال من ساعة ونصف إلى ساعتين.
تضمن عملية Na-catenation تليين الماء إلى 0.05 مللي مكافئ/لتر. في الممارسة العملية، يتم استخدام عملية Na-cationization على مرحلتين. تقوم مرشحات المرحلة الأولى بتليين الماء بشكل خشن، مما يقلل من عسر الماء بنسبة 75% تقريبًا. تتم إزالة الصلابة المتبقية عن طريق الترشيح المتكرر من خلال مرشحات المرحلة الثانية. يتم الاحتفاظ بالجزء الأكبر من أيونات الكالسيوم والمغنيسيوم بواسطة مرشحات المرحلة الأولى، بينما تتحمل مرشحات المرحلة الثانية حملاً طفيفًا من حيث الصلابة وتستمر دورة تشغيلها حتى 150 إلى 200 ساعة. الكاتيون هو 0.01¼0.02 مكافئ/لتر. تؤدي طريقة تخفيف الماء هذه إلى توفير الملح عند تجديد مرشحات المرحلة الأولى. ولهذا الغرض، يتم استخدام مياه الغسيل من مرشحات المرحلة الثانية. بالإضافة إلى ذلك، تعمل عملية تحويل الصوديوم على مرحلتين على تبسيط عملية التثبيت عن طريق إطالة دورة المرشح ولا تتطلب صيانة مستمرة للمرشح.
أثناء عملية الـ cationation تحدث العمليات التالية:
2NaR + Ca (HCO3) 2 lag CaR 2 + 2NaHCO 3 ;
2NaR + Mg (HCO 3) 2 lag MgR 2 + 2NaHCO 3 ;
2NaR + CaSO 4 lag CaR 2 + Na 2 SO 4 ;
2NaR + MgCl 2 μ MR 2 + 2NaCl .
عند ترشيح المياه التي تحتوي على صلابة غير كربوناتية يتم الحصول على أملاح الأحماض القوية والقواعد القوية. هذه الأملاح لا تخضع للتحلل المائي حتى في درجات الحرارة المرتفعة. ولكن عند إزالة صلابة الكربونات، تتكون بيكربونات الصوديوم، التي تتحلل عند درجات حرارة عالية لتشكل مادة قلوية قوية:
NaHCO 3 + H2O 👉 NaOH + H2CO 3.
لتقليل قلوية الماء، يتم ترشيحه بشكل متسلسل من خلال مبادلات Na- ثم H-cation، أو يتم تقسيم التدفق إلى قسمين، يتم تمرير أحدهما من خلال مبادل Na-cation، والثاني من خلال مبادل H-cation، ومن ثم يتم خلط المرشحات.
الطريقة الحرارية لتليين المياه.عند تسخين الماء حتى الغليان، تتحول بيكربونات الكالسيوم والمغنيسيوم إلى كربونات وفقًا للمخططات التالية:
Ca (HCO 3) 2 = CaCO 3 ↓+ CO 2 + H 2 O؛
Mg(HCO 3) 2 = MgCO 3 + CO 2 + H 2 O.
يمكن تحويل هذه العمليات العكسية بالكامل تقريبًا إلى اليمين عن طريق الماء المغلي، لأنه عند درجات الحرارة المرتفعة تنخفض قابلية ذوبان ثاني أكسيد الكربون. ومع ذلك، لا يمكن التخلص من عسر الكربونات بشكل كامل، حيث أن كربونات الكالسيوم، على الرغم من أنها قليلة (حوالي 9.95 ملغم/لتر عند 15 درجة مئوية)، قابلة للذوبان في الماء. إن قابلية ذوبان MgCO 3 عالية جدًا (110 مجم / لتر)، لذلك، أثناء الغليان لفترة طويلة، يتحلل ليشكل هيدروكسيد المغنيسيوم القابل للذوبان قليلاً (8 مجم / لتر):
MgCO 3 + H 2 O μ Mg (OH) 2 ↓ + CO 2 .
الغليان يزيل جزئيا صلابة الكبريتات، حيث أن ذوبان كبريتات الكالسيوم يتناقص مع زيادة درجة الحرارة. يمكن استخدام هذه الطريقة لتليين المياه التي تحتوي في الغالب على صلابة كربونات وتستخدم لتغذية غلايات الضغط المنخفض والمتوسط.
الطرق الأساسية لتليين المياه
الأسس النظرية لتليين المياه وتصنيف الطرق
الطريقة الحرارية لتليين المياه
طرق الكاشف لتليين المياه
المخططات التكنولوجية و العناصر الهيكليةكاشف محطات تليين المياه
طريقة تليين المياه الكيميائية الحرارية
تليين الماء عن طريق غسيل الكلى
معالجة المياه المغناطيسية
الأدب
الأسس النظرية لتليين المياه وتصنيف الطرق
يشير تليين الماء إلى عملية إزالة الكاتيونات العسر منه، أي. الكالسيوم والمغنيسيوم.وفقًا لـ GOST 2874-82 "مياه الشرب"، يجب ألا تتجاوز صلابة الماء 7 ملي مكافئ / لتر. تتطلب أنواع معينة من الإنتاج تليينًا عميقًا للمياه المعالجة، على سبيل المثال. ما يصل إلى 0.05.0.01 مللي مكافئ / لتر. تتمتع مصادر المياه المستخدمة عادةً بصلابة تلبي معايير مياه الشرب ولا تتطلب تليينها. يتم إجراء عملية تليين المياه بشكل أساسي أثناء تحضيرها للأغراض الفنية. وبالتالي، يجب ألا تتجاوز صلابة الماء المستخدمة في تغذية غلايات الأسطوانة 0.005 مكافئ/لتر. يتم تنفيذ تليين المياه بالطرق التالية: الحرارية، على أساس تسخين المياه، وتقطيرها أو تجميدها؛ الكواشف، التي تتواجد فيها الأيونات في الماءكاليفورنيا (ثانيا ) وملغ (ثانيا ) ربط مع الكواشف المختلفة في مركبات غير قابلة للذوبان عمليا؛ التبادل الأيوني، الذي يعتمد على تصفية الماء المخفف من خلال مواد خاصة تقوم بتبادل الأيونات الداخلة في تركيبهانا (أنا ) أو H (1) إلى أيونات Ca (II) وملغ (ثانيا ), الموجودة في ماء غسيل الكلى. مجتمعة، تمثل مجموعات مختلفة من الطرق المذكورة.
يتم تحديد اختيار طريقة معالجة المياه حسب جودتها وعمق المعالجة المطلوب والاعتبارات الفنية والاقتصادية. وفقًا لتوصيات SNiP عند تليين المياه الجوفية، يجب استخدام طرق التبادل الأيوني؛ عند تليين المياه السطحية، عندما تكون هناك حاجة أيضًا إلى تنقية المياه، يتم استخدام طريقة الجير أو الصودا الجيرية، وعندما تكون المياه العميقة، يتم استخدام الكاتيون اللاحق.ويرد في الجدول الخصائص والشروط الرئيسية لاستخدام طرق تخفيف المياه. 20.1.
تليين غسيل الكلى الحراري
للحصول على المياه اللازمة للاحتياجات المنزلية والشربية، عادة ما يتم تخفيف جزء معين منه فقط، ثم يتم خلطه مع مياه المصدر، في حين أن كمية المياه المخففة س ذتحددها الصيغة
أين هو جو. و. - العسر الإجمالي لمياه المصدر، مكافئ/لتر؛ ف 0. ق. - إجمالي عسر الماء الداخل إلى الشبكة، ملي مكافئ/لتر؛ و 0. ش. - صلابة الماء الميسر (mEq/l).
طرق تليين المياه
|
فِهرِس |
الحرارية |
كاشف |
التبادل الأيوني |
|
|
خصائص العملية |
يتم تسخين الماء إلى درجة حرارة أعلى من 100 درجة مئوية مما يزيل الكربونات والصلابة غير الكربونية (على شكل كربونات الكالسيوم والهيدروكسي والمغنيسيوم والجبس). |
يضاف إلى الماء الجير الذي يزيل العسر الكربوني والمغنسيوم، وكذلك الصودا التي تزيل العسر غير الكربوني. |
يتم تمرير الماء المراد تخفيفه من خلال مرشحات مبادل الكاتيون |
يتم ترشيح مياه المصدر من خلال غشاء شبه منفذ |
|
الغرض من الطريقة |
إزالة عسر الكربونات من المياه المستخدمة لتغذية غلايات الضغط المنخفض والمتوسط |
تليين سطحي مع تنقية الماء من المواد الصلبة العالقة في نفس الوقت |
تليين عميق للمياه يحتوي على كمية صغيرة من المواد الصلبة العالقة |
تليين المياه العميقة |
|
استهلاك المياه للاحتياجات الخاصة |
لا يزيد عن 10% |
تصل إلى 30% أو أكثر بما يتناسب مع عسر الماء المصدر |
||
|
شروط الاستخدام الفعال: تعكر مياه المصدر، ملغم/لتر |
لا يزيد عن 8 |
|||
|
صلابة الماء، مكافئ / لتر |
صلابة كربونات مع غلبة الكالسيوم (HC03) 2، صلابة غير كربونات على شكل جبس |
لا يزيد عن 15 |
||
|
صلابة المياه المتبقية، مكافئ / لتر |
صلابة الكربونات تصل إلى 0.035، CaS 04 تصل إلى 0.70 |
0.03.0.05 prn أحادي المرحلة وما يصل إلى 0.01 مع كاتيون على مرحلتين |
0.01 وما دون |
|
|
درجة حرارة الماء، درجة مئوية |
ما يصل إلى 30 (جلوكونيت)، ما يصل إلى 60 (سلفونيت) |
الطريقة الحرارية لتليين المياه
يُنصح باستخدام الطريقة الحرارية لتليين المياه عند استخدام المياه الكربونية المستخدمة لتغذية الغلايات ذات الضغط المنخفض، وكذلك بالاشتراك مع الطرق الكاشفة لتليين المياه. ويعتمد على تحول في توازن ثاني أكسيد الكربون عند تسخينه نحو تكوين كربونات الكالسيوم، وهو ما يوصف بالتفاعل
Ca (HC0 3) 2 -> CaCO 3 + C0 2 + H 2 0.
ينزاح التوازن بسبب انخفاض ذوبان أول أكسيد الكربون (IV) الناتج عن زيادة درجة الحرارة والضغط. يمكن أن يؤدي الغليان إلى إزالة أول أكسيد الكربون (IV) تمامًا وبالتالي تقليل صلابة كربونات الكالسيوم بشكل كبير. ومع ذلك، ليس من الممكن القضاء على هذه الصلابة تمامًا، نظرًا لأن كربونات الكالسيوم، على الرغم من أنها قليلة (13 مجم / لتر عند درجة حرارة 18 درجة مئوية)، لا تزال قابلة للذوبان في الماء.
في حالة وجود بيكربونات المغنيسيوم في الماء، فإن عملية ترسيبها تتم على النحو التالي: أولاً، يتم تكوين كربونات المغنيسيوم عالية الذوبان نسبياً (110 ملغم/لتر عند درجة حرارة 18 درجة مئوية).
ملغ (HCO 3) → ملغمك 0 3 + C0 2 + H 2 0،
والذي يتحلل أثناء الغليان لفترة طويلة، مما ينتج عنه راسب قليل الذوبان (8.4 مجم/ لتر). هيدروكسيد المغنيسيوم
MgC 0 3 +H 2 0 → Mg (0H) 2 +C 0 2.
ونتيجة لذلك، عندما يغلي الماء، تنخفض الصلابة الناتجة عن بيكربونات الكالسيوم والمغنيسيوم. عندما يتم غليان الماء، تنخفض أيضًا عسر الماء، التي تحددها كبريتات الكالسيوم، وتنخفض قابلية ذوبانه إلى 0.65 جم / لتر.
في التين. يُظهر الشكل 1 مخففًا حراريًا صممه Kopyev، ويتميز بالبساطة النسبية للجهاز والتشغيل الموثوق. يدخل الماء المعالج، المسخن مسبقًا في الجهاز، من خلال القاذف إلى مقبس سخان الفيلم ويتم رشه فوق الأنابيب الموضوعة عموديًا، ويتدفق من خلالها نحو البخار الساخن. بعد ذلك، يدخل مع الماء المتدفق من الغلايات إلى المصفى مع الرواسب المعلقة من خلال أنبوب الإمداد المركزي من خلال القاع المثقوب.
يتم إطلاق ثاني أكسيد الكربون والأكسجين المنطلق من الماء مع البخار الزائد في الغلاف الجوي. يتم الاحتفاظ بأملاح الكالسيوم والمغنيسيوم المتكونة أثناء تسخين الماء في الطبقة المعلقة. بعد المرور عبر الطبقة المعلقة، يدخل الماء المخفف إلى خزان التجميع ويتم تفريغه خارج الجهاز.
مدة بقاء الماء في المنقي الحراري 30.45 دقيقة، وسرعة حركته للأعلى في الطبقة المعلقة 7.10 م/ساعة، وفي فتحات القاع الكاذب 0.1-0.25 م/ث.

أرز. 1. المنقي الحراري الذي صممه Kopyev.
15 - تصريف مياه الصرف الصحي. 12 - أنبوب الإمداد المركزي؛ 13 - قيعان مثقبة كاذبة. 11 - الطبقة المعلقة. 14 - تصريف الحمأة. 9 - جمع الماء المخفف 1, 10 - توفير مياه المصدر وإزالة المياه الميسرة؛ 2 - نفخ الغلايات 3 - القاذف. 4 - التبخر. 5 - سخان الفيلم 6 - إطلاق البخار. 7 - خط أنابيب مثقوب لتصريف المياه إلى القاذف؛ 8 - أقسام الفصل المائلة
طرق الكاشف لتليين المياه
يعتمد تخفيف الماء باستخدام الطرق الكاشفة على معالجته بكواشف تشكل مركبات ضعيفة الذوبان مع الكالسيوم والمغنيسيوم: Mg (OH) 2، CaC0 3، Ca 3 (P0 4) 2، Mg 3 (P 0 4) 2 وغيرها، يلي ذلك فصلها إلى أجهزة تنقية وخزانات ترسيب ذات طبقة رقيقة ومرشحات تنقية. يتم استخدام الجير ورماد الصودا وهيدروكسيدات الصوديوم والباريوم ومواد أخرى ككواشف.
تليين المياه عن طريق التجييريستخدم في الحالات ذات العسر الكربوني العالي والمنخفض غير الكربوني، وكذلك في الحالات التي لا يكون فيها من الضروري إزالة الأملاح غير الكربونية من الماء. يستخدم الجير ككاشف، والذي يتم تقديمه على شكل محلول أو معلق (حليب) في الماء المعالج المسخن مسبقًا. عند ذوبانه، يقوم الجير بإثراء الماء بأيونات OH - وCa 2+، مما يؤدي إلى ربط أول أكسيد الكربون الحر (IV) المذاب في الماء مع تكوين أيونات الكربونات وانتقال أيونات الهيدروكربونات إلى أيونات كربونات:
C0 2 + 20H - → CO 3 + H 2 0، HCO 3 - + OH - → CO 3 - + H 2 O.
إن زيادة تركيز أيونات CO 3 2 في المياه المعالجة ووجود أيونات Ca 2+ فيها مع مراعاة تلك المدخلة مع الجير يؤدي إلى زيادة ناتج الذوبان وترسيب كربونات الكالسيوم ضعيفة الذوبان. :
Ca 2+ + C0 3 - → CaC0 3.
إذا كان هناك فائض من الجير، يترسب هيدروكسيد المغنيسيوم أيضا.
ملغ 2+ + 20H - → ملغ (OH) 2
لتسريع عملية إزالة الشوائب المشتتة والغروية وتقليل قلوية الماء، يتم استخدام تخثر هذه الشوائب بكبريتات الحديد (II) في وقت واحد مع الجير، أي. FeS 0 4 *7 H 2 0. يمكن الحصول على الصلابة المتبقية للمياه المخففة أثناء إزالة الكربون بمقدار 0.4-0.8 ملجم-مكافئ/لتر أكثر من الصلابة غير الكربونية، وتكون القلوية 0.8-1.2 ملجم-مكافئ/لتر. يتم تحديد جرعة الجير بنسبة تركيز أيونات الكالسيوم في الماء وعسر الكربونات: أ) بنسبة [Ca 2+ ] /20<Ж к,
ب) مع النسبة [Ca 2+ ] /20 > J c،
حيث [CO 2 ] هو تركيز أول أكسيد الكربون الحر (IV) في الماء، ملغم/لتر؛ [Ca 2+ ] - تركيز أيونات الكالسيوم، ملغم/لتر؛ Fc - صلابة كربونات الماء، مكافئ/لتر؛ D k - جرعة مادة التخثر (FeS 0 4 أو FeCl 3 فيما يتعلق بالمنتجات اللامائية)، ملغم/لتر؛ ه ل- الكتلة المكافئة للمادة الفعالة للمخثر، mg/mg-eq (بالنسبة لـ FeS 0 4 هك = 76، لFeCl 3 ه ك = 54)؛ 0.5 و 0.3 - جير زائد لضمان اكتمال التفاعل، ملي مكافئ/لتر.
وتؤخذ عبارة D k / e k بعلامة الناقص إذا تم إدخال المخثر قبل الجير، وبعلامة الزائد إذا كانا معاً أو بعده.
في حالة عدم وجود بيانات تجريبية، يتم العثور على جرعة التخثر من التعبير
د ك = 3 (ج) 1/3، (20.4)
حيث C هي كمية المادة العالقة المتكونة أثناء تليين الماء (من حيث المادة الجافة)، ملغم/لتر.
وفي المقابل، يتم تحديد C باستخدام التبعية
طريقة الصودا والليمون لتليين المياهيوصف بالتفاعلات الأساسية التالية:
باستخدام هذه الطريقة، يمكن رفع الصلابة المتبقية إلى 0.5.1، والقلوية من 7 إلى 0.8.1.2 ملي مكافئ/لتر.
يتم تحديد جرعات الجير D والصودا D s (من حيث Na 2 C 0 3)، ملغم / لتر، بواسطة الصيغ
 (20.7)
(20.7)
أين هو محتوى المغنيسيوم في الماء، ملغم / لتر؟ جون. ك. - صلابة المياه غير الكربونية، مكافئ/لتر.
باستخدام طريقة الصودا الجيرية لتليين الماء، يمكن لكربونات الكالسيوم وهيدروكسيد المغنسيوم الناتجة أن تزيد من تشبع المحاليل وتبقى في حالة غروية مشتتة لفترة طويلة. يستغرق انتقالهم إلى الحمأة الخشنة وقتا طويلا، خاصة عندما درجات الحرارة المنخفضةووجود شوائب عضوية في الماء تعمل بمثابة غرويات واقية. مع كمية كبيرة منها، يمكن تقليل صلابة الماء أثناء تليين الماء الكاشف بنسبة 15.20% فقط. في مثل هذه الحالات، قبل التليين أو أثناء عملية التليين، تتم إزالة الشوائب العضوية من الماء باستخدام عوامل مؤكسدة ومخثرات. باستخدام طريقة صودا الليمون، غالبًا ما تتم العملية على مرحلتين. في البداية، تتم إزالة الشوائب العضوية وجزء كبير من صلابة الكربونات من الماء،وذلك باستخدام أملاح الألمنيوم أو الحديد مع الجير، وتنفيذ العملية في ظل ظروف التخثر المثلى. بعد ذلك يتم إدخال الصودا وبقية الجير وتخفيف الماء.عند إزالة الشوائب العضوية في وقت واحد مع تليين الماء، يتم استخدام أملاح الحديد فقط كمواد تخثر، لأنه عند قيمة الرقم الهيدروجيني العالية للمياه اللازمة لإزالة صلابة المغنيسيوم، لا تشكل أملاح الألومنيوم هيدروكسيد نشط الامتصاص. يتم حساب جرعة التخثر في غياب البيانات التجريبية باستخدام الصيغة (20.4). يتم تحديد مقدار التعليق بواسطة الصيغة
حيث W o - إجمالي صلابة الماء، مكافئ / لتر.
يمكن تحقيق تليين أعمق للمياه عن طريق تسخينها وإضافة كمية زائدة من كاشف الترسيب وجعل الماء المخفف يتلامس مع الرواسب التي تكونت مسبقًا. عند تسخين الماء، تقل قابلية ذوبان CaCO 3 وMg (OH) 2 وتحدث تفاعلات التليين بشكل كامل.
المؤسسة التعليمية الحكومية الفيدرالية للتعليم المهني العالي
"الجامعة الفيدرالية السيبيرية"
معهد البوليتكنيك
مقال
طرق تصفية وتخفيف المياه.
استخدام مثبط IOMS.
رئيس ________________ ياكوفينكو أ.
الطالب TE 06 - 03 ________________ مينيفا د.
كراسنويارسك 2009 
طرق تنقية المياه.
يشير تنقية المياه إلى إطلاق المواد العالقة منه أثناء الحركة المستمرة للمياه عبر هياكل خاصة (المستوطنات، المصافي) بسرعات منخفضة. عند السرعات المنخفضة لحركة الماء، تحتوي على مواد معلقة تكون جاذبيتها النوعية أكبر جاذبية معينةيترسب الماء تحت تأثير الجاذبية، ويشكل رواسب في خزان الترسيب.
يتم تحديد المخططات التكنولوجية لمعالجة المياه في كل حالة محددة حسب المتطلبات وتشمل مراحل العمل التالية:
الدراسات التكنولوجية والاختبارات المعملية الأولية للكواشف المستخدمة؛
اختيار وحساب المعدات اللازمة لجرعات الكواشف وخلطها؛
اختيار المعدات اللازمة لتصفية الطبقة الرقيقة وضغط التعليق؛
اختيار وحساب المرشحات السريعة ذات التحميل الحبيبي، سواء الضغط أو الأنواع المفتوحة؛
اختيار التكنولوجيا والمعدات اللازمة لنزح المياه من الحمأة والتخلص منها لاحقًا؛
اختيار معدات التطهير عن طريق جرعات محلول الكلور (هيبوكلوريت الصوديوم) ومراقبة جودة المياه المعالجة.
اعتمادًا على اتجاه حركة المياه، تنقسم خزانات الترسيب إلى أفقية ورأسية وقطرية.
خزان الترسيب الأفقي (الشكل 1) عبارة عن خزان مستطيل الشكل، يتم توجيه محوره الطولي (الأطول) على طول حركة الماء. يتم توجيه المياه المصفى من خلال الأنبوب 1 إلى مجرى التوزيع 2، الذي يحتوي على عدد من الفتحات التي تعمل على توزيع تدفق المياه بالتساوي عبر المقطع العرضي للحوض. ويجب ألا تزيد سرعة حركة الماء في هذه الثقوب عن 0.4 م/ث. يتدفق الماء المصفى إلى خندق آخر 3 ومنه عبر الأنبوب 4 يتم تفريغه إلى المرشحات. تتراكم الجزيئات المستقرة (الحمأة) في القاع، والتي يجب أن يكون لها منحدر معاكس لحركة الماء.
عادة ما يؤخذ زمن الترسيب في صهاريج الترسيب الأفقية للخليط المتخثر ألا يزيد عن 4 ساعات، ويمكن تقسيم صهاريج الترسيب الأفقية لتصفية كميات كبيرة من الماء من حيث الارتفاع إلى عدة حجرات (طوابق) متوازية. تتمثل مزايا خزانات تسوية الطوابق (اقتراح البروفيسور P.I. Piskunov) في مساحة بناء صغيرة واستهلاك أقل للخرسانة. تم بناء خزان الترسيب هذا في واحدة من أكبر محطات معالجة مياه الصرف الصحي في الاتحاد السوفيتي.

أرز. 1. رسم تخطيطي لخزان الترسيب الأفقي: 1 - صينية؛ 2 - غرفة الاستقبال. 3 - تلقي شلال. 4 - للمرشح. 5- لإزالة الرواسب

أرز. 2. مخطط خزان الترسيب العمودي 1 - الأنبوب المركزي. 2-صينية؛ 3- أنبوب المخرج. 4- خط أنابيب لإزالة الرواسب
خزانات الترسيب العمودية (الشكل 2) عبارة عن خزان دائري، وأحيانًا مربع، ذو قاع مخروطي الشكل وأنبوب مركزي يتم إمداده بالمياه النقية من غرفة تكوين الندف.
عند الخروج من الأنبوب المركزي إلى الحوض، يتحرك الماء للأعلى بسرعة منخفضة ويتم تصريفه، بعد تصفيته، من خلال جانب مزراب ذو موقع متحد المركز، حيث يتم تفريغه إلى المرشح. تتم إزالة الرواسب التي تسقط في قاع خزان الترسيب بشكل دوري.
يؤخذ معدل تدفق المياه في الأنبوب المركزي من 30 إلى 75 ملم / ثانية. زمن ترسيب الماء في خزان الترسيب هو T = 2 ساعة، وسرعة حركة الماء إلى الأعلى هي 0.5-0.6 ملم/ثانية.
يجب ألا يتجاوز قطر خزان الترسيب 12 مترًا، وعادةً ما تكون نسبة القطر إلى ارتفاع خزان الترسيب لا تزيد عن 1.5.
خزانات الترسيب الشعاعي عبارة عن خزانات مستديرة ذات قاع مخروطي قليلاً. يدخل الماء إلى الأنبوب المركزي ويتم توجيهه منه في اتجاه شعاعي إلى صينية التجميع على طول محيط الحوض. تتميز خزانات الترسيب بعمق ضحل، حيث تتم إزالة الرواسب ميكانيكيًا دون تعطيل عمل خزان الترسيب. يتم إنشاء خزانات الترسيب الشعاعية بقطر 10 لتر* أو أكثر وبعمق يتراوح بين 1.5-2.5 متر (عند جدار خزان الترسيب) إلى 3-5 متر (في المركز).
يعتمد اختيار نوع خزان الترسيب على الإنتاج اليومي للمحطة، والتخطيط العام، والتضاريس، وطبيعة التربة، وما إلى ذلك. ويوصى باستخدام خزانات الترسيب العمودية بقدرة إنتاجية يومية تصل إلى 3000 م3. تستخدم خزانات الترسيب الأفقية عندما تزيد سعة المحطة عن 30.000 م3/يوم سواء في حالة تخثر الماء أو بدونه.
تعتبر خزانات الترسيب الشعاعي مناسبة لتدفقات المياه العالية (أكثر من 40.000 م3/يوم). تتمثل ميزة خزانات الترسيب هذه مقارنة بالخزانات الأفقية المستطيلة في الإزالة الآلية للرواسب دون إيقاف تشغيل خزان الترسيب. يتم استخدامها في حالة التعكر العالي لمياه النهر (مع أو بدون تخثر) بشكل أساسي لتنقية المياه الصناعية.
الموضحات مع الرواسب المعلقة. تتم عملية التنقية بشكل أكثر كثافة إذا تم تمرير الماء المصفى، بعد التخثر، عبر كتلة من الرواسب المتكونة مسبقًا، والتي يتم الاحتفاظ بها في حالة تعليق بواسطة تيار



أرز. 3. الموضحات: أ - التصميم الأصلي؛ ب - نوع الممر : 1 - أنابيب التوزيع . 2 - المزاريب ذات الثقوب المغمورة بالمياه. 3 - جزء العمل من المصفي. 4- منطقة الحماية. 5 - علبة المخرج. 6 - أنابيب لامتصاص الرواسب. 7 - نوافذ هطول الأمطار. 8-ضاغطة الرواسب؛ 9 - أنابيب لتصريف الرواسب ) 10 - أنابيب لتصريف المياه الصافية
توفر هذه المصفيات تأثيرًا أعلى لتصفية المياه مقارنة بخزانات الترسيب التقليدية، وهو ما يفسره التوسيع السريع للمادة المعلقة والاحتفاظ بها عندما يمر الماء المتخثر عبر الرواسب العالقة.
إن استخدام جهاز تنقية مع بقايا معلقة يجعل من الممكن، بالمقارنة مع خزان الترسيب التقليدي، تقليل استهلاك مادة التخثر، وتقليل حجم الهياكل والحصول على تأثير أعلى لتصفية المياه.
إن توضيح التصميم الأصلي عبارة عن خزان أسطواني به ضاغط للحمأة في الجزء المركزي منه (الشكل 3، أ). هنا، يدخل الماء مع الكاشف إلى فاصل الهواء، ثم يمر إلى أسفل إلى أنابيب التوزيع المثقبة 1، ثم إلى فتحات القاع المثقب 2.
يدخل الماء، الذي يمر عبر طبقة الرواسب المعلقة 3، إلى منطقة التوضيح 4 ويتدفق إلى مزاريب المخرج. تدخل الرواسب المعلقة الزائدة إلى خزان الحمأة 5، حيث يتم إزالتها بشكل دوري إلى نظام الصرف الصحي.
المصافي من نوع الممر (انظر الشكل 3، ب) عبارة عن خزان مستطيل. يدخل الماء المتخثر إلى المصفي من خلال الأنبوب 1 ويتم توزيعه من خلال الأنابيب المثقبة 2 في الجزء السفلي (العامل) 3 من المصفي. يجب أن تكون سرعة حركة الماء في جزء العمل بحيث يتم تعليق رقائق التخثر. تساعد هذه الطبقة على الاحتفاظ بالجزيئات العالقة. درجة تنقية المياه أعلى بكثير مما هي عليه في خزان الترسيب التقليدي.
توجد فوق جزء العمل منطقة حماية 4، حيث لا توجد طبقة معلقة. يتم تفريغ الماء المصفى بواسطة الدرج 5 والأنابيب 10 للمعالجة اللاحقة. يتم تصريف الكمية الزائدة من الرواسب من خلال الشفط إلى الأنبوب 6 من خلال النوافذ 7 إلى ضاغطة الرواسب 8، حيث يتم ضغط الرواسب وتصريفها بشكل دوري إلى المجاري من خلال الأنابيب 9.
تعتبر سرعة التدفق التصاعدي في الجزء العامل من جهاز التصفية 1-1.2 مم / ثانية.
طرق تليين المياه.
يجب أن تتم عملية إزالة أملاح العسر من الماء أي تخفيفه لتشغيل محطات الغلايات ويجب ألا تزيد عسر الماء في غلايات الضغط المتوسط والمنخفض عن 0.3 ملجم مكافئ/لتر. يعد تخفيف الماء مطلوبًا أيضًا في صناعات مثل النسيج والورق والصناعات الكيماوية، حيث يجب أن لا تزيد عسر الماء عن 0.7-1.0 ملجم مكافئ/لتر. وينصح أيضًا بتحلية المياه للأغراض المنزلية والشرب، خاصة إذا تجاوزت 7 ملجم مكافئ/لتر.
يتم استخدام الطرق الرئيسية التالية لتليين المياه:
1) طريقة الكاشف - عن طريق إدخال الكواشف التي تعزز تكوين مركبات الكالسيوم والمغنيسيوم ضعيفة الذوبان وترسيبها؛
2) طريقة التبادل الكاتيوني، حيث يتم ترشيح الماء المخفف من خلال مواد لها القدرة على استبدال الكاتيونات التي تحتويها (الصوديوم أو الهيدروجين) بكاتيونات الكالسيوم والمغنيسيوم والأملاح الذائبة في الماء. ونتيجة للتبادل، يتم الاحتفاظ بأيونات الكالسيوم والمغنيسيوم وتتكون أملاح الصوديوم، والتي لا تضفي صلابة على الماء؛
3) الطريقة الحرارية، وهي عبارة عن تسخين الماء إلى درجة حرارة أعلى من 100 درجة مئوية، مما يؤدي إلى إزالة أملاح عسر الكربونات بشكل شبه كامل.
غالبًا ما يتم استخدام طرق التليين معًا. على سبيل المثال، تتم إزالة جزء من أملاح الصلابة بطريقة الكاشف، ويتم إزالة الجزء المتبقي باستخدام التبادل الكاتيوني.
من بين طرق الكاشف، تعد طريقة تليين الصودا والجير هي الأكثر شيوعًا. يتلخص جوهرها في الحصول على أملاح CaC0 3 و Mg(OH) 2 غير القابلة للذوبان بدلاً من أملاح Ca Mg المذابة في الماء.
يتم إدخال كلا الكواشف - الصودا Na 2 C0 3 والجير Ca (OH) 2 - في الماء لتليينهما في وقت واحد أو بالتناوب.
تتم إزالة أملاح الكربونات ذات الصلابة المؤقتة بالجير وغير الكربونات والصلابة الدائمة بالصودا. تتم التفاعلات الكيميائية عند إزالة صلابة الكربونات على النحو التالي:
Ca (HC0 3) 2 + Ca (OH) 2 = 2 CaC0 3 + 2H 2 0.
في هذه الحالة، تترسب كربونات الكالسيوم CaCO3. عند إزالة بيكربونات المغنيسيوم Mg(HC0 3) 2، يكون التفاعل كالتالي:
Mg (HCOa)2 + 2Ca (OH) 2 = Mg (OH) 2 + 2CaC0 3 + 2H 2 0.
يتخثر أكسيد المغنيسيوم Mg(OH)2 ويترسب. وللتخلص من العسر غير الكربوني، تتم إضافة Na2C03 إلى الماء الذي يتم تخفيفه. التفاعلات الكيميائية عند إزالة الصلابة غير الكربونية هي كما يلي:
Na 2 C0 8 + CaS0 4 = CaCO 8 + Na 2 S0 4 ;
Na 2 CO 3 + CaCl 2 = CaC0 3 + 2NaCl.
ونتيجة للتفاعل يتم الحصول على كربونات الكالسيوم التي تترسب.
للتليين العميق، يتم استخدام تدابير مساعدة، مثل تسخين المياه المعالجة إلى ما يقرب من 90، في حين يمكن زيادة الصلابة المتبقية إلى 0.2-0.4 ملغم مكافئ / لتر.
وبدون تسخين تتم معالجة المياه بجرعات زائدة كبيرة من الجير، يليها إزالة هذه الزوائد عن طريق نفخ الماء بثاني أكسيد الكربون. العملية الأخيرة تسمى إعادة الكربنة.
في التين. يوضح الشكل 4 رسمًا تخطيطيًا لمحطة معالجة المياه الكاشفة، والتي تشتمل على جهاز لتحضير وجرعات محاليل الكاشف، والخلاطات، وغرف التفاعل، وأجهزة التوضيح، والمرشحات.
لتليين المياه الموردة بشكل موحد والتي تتدفق بشكل مستمر، يتم استخدام نفس موزعات محاليل الصودا والجير كما في عملية التخثر. إذا كان معدل تدفق الماء الميسر يتقلب، يتم استخدام ما يسمى بالموزعات التناسبية.

أرز. 4. مخطط تخفيف الماء الكاشف: 1 - غرفة التفاعل (مفاعل دوامي)؛ 2 - توضيح. 3 - مرشح الكوارتز. 4 - خلاط. 5 و 6 و 7 - موزعات للحلول الكاشفة؛ 8 و 9 و 10 - خزانات لإذابة مواد التخثر والصودا لتحضير حليب الليمون؛ 11 - دبابة. 12 - مضخة. 13- فاصل الهواء .
تعتبر طريقة الصودا والجير مناسبة لتليين المياه بأي نسبة من الكربونات والصلابة غير الكربونية.
عيوب طريقة تليين الصودا والجير هي كما يلي: 1) الماء غير مخفف بالكامل؛ 2) منشآت التليين ضخمة. 3) مطلوب جرعة دقيقة من الصودا والجير، وهو أمر يصعب تحقيقه بسبب تباين تركيبة الماء المخفف والكواشف.
تعتمد طريقة تليين الكاتيت على قدرة المواد التي تسمى الكاتيونات على استبدال كاتيونات الصوديوم Na+ أو هيدروجين H+ التي تحتويها بكاتيونات الكالسيوم أو المغنيسيوم الذائبة في الماء. وفقًا لهذا، يتم التمييز بين كاتيت الصوديوم وهيدروجين الصوديوم: طرق الكاتيت لتليين المياه.
بمساعدة مبادلات الكاتيون، يتم تخفيف الماء في منشأة تتكون من عدة خزانات ضغط معدنية محملة بمبادل الكاتيون (الشكل 5).
تدخل المياه غير المعالجة إلى الفلتر من خلال الأنابيب A وB وC؛ يتم إطلاق الماء المخفف من خلال الأنبوب G. عندما يكون المرشح قيد التشغيل، يكون الصمامان 2 و5 مفتوحين، ويتم إغلاق الصمامات الأخرى (1 و3 و4 و6). قبل التجديد، يتم غسل الفلتر.
لغسل الفلتر، يتم إمداد الماء من الخزان D عبر الأنبوب E ويمر عبر المصارف من الأسفل إلى الأعلى. مدة الغسيل 20-30 دقيقة، كثافة 4-6 لتر/ثانية لكل 1 م2. يتم تصريف مياه الغسيل من المرشحات من خلال الأنابيب B، B، F، مع فتح الصمامات 4 و 3 والباقي مغلق.
أثناء التجديد، يتم توفير محلول التبادل الكاتيوني المتجدد من خلال الأنبوب B، ويمر عبر المرشح من الأعلى إلى الأسفل ويتم تفريغه عبر الأنبوب. في هذه الحالة، يكون الصمامان 1 و6 مفتوحين، أما الصمامان الآخران (2-5) فيغلقان؛ مدة التجديد حوالي 30-60 دقيقة، والغسيل من محلول التجديد هو 40-60 دقيقة.

أرز. 5. مخطط محطة معالجة المياه الكاتيتية
مزايا طريقة التبادل الكاتيوني هي كما يلي: 1) يتم تخفيف الماء بشكل كامل تقريباً؛ 2) ما عليك سوى تناول محلول ملح الطعام أو حمض الكبريتيك؛ 3) يتم تصنيع الفلاتر بطريقة المصنع. وتشمل عيوب هذه الطريقة الحاجة إلى تصفية المياه مسبقًا، نظرًا لأن المواد الغروية والعضوية تغلف حبيبات راتنجات التبادل الكاتيوني وتقلل من قدرتها التبادلية.
يتم إدخال الكواشف المستخدمة في معالجة المياه إلى الماء في الأماكن التالية:
أ) الكلور (أثناء الكلورة الأولية) - في خطوط أنابيب الشفط لمحطة الضخ الأولى أو في خطوط أنابيب المياه التي تزود محطة المعالجة بالمياه؛
ب) مادة التخثر - في خط الأنابيب أمام الخلاط أو في الخلاط؛
ج) الجير للقلوية أثناء التخثر - في وقت واحد مع مادة التخثر؛
د) الكربون المنشط لإزالة الروائح والطعم في الماء حتى 5 ملجم/لتر - قبل المرشحات. بجرعات كبيرة، يجب إدخال الفحم في أول محطة ضخ رفع أو في وقت واحد مع مادة التخثر في خلاط محطة معالجة المياه، ولكن ليس قبل 10 دقائق من إدخال الكلور؛
ه) يتم إدخال الكلور والأمونيا لتطهير المياه حتى مرافق معالجةوفي الماء المصفى. في حالة وجود الفينولات في الماء، يجب إضافة الأمونيا أثناء عملية الكلورة الأولية والنهائية.
يتم تحضير محلول التخثر في خزانات المحلول؛ من حيث ينبغي إطلاقها أو ضخها في صهاريج الإمداد. لتوفير كمية معينة من محلول التخثر إلى الماء، يجب تركيب موزعات.
عند استخدام الموزعات الأوتوماتيكية التي تعتمد على مبدأ تغيير التوصيل الكهربائي للمياه اعتمادا على الشوائب، يجب إدخال الجير للقلونة بعد جمع المياه المتخثرة التي تذهب إلى الموزع.
وتشمل الأنواع الخاصة لتنقية ومعالجة المياه: تحلية المياه، وتحلية المياه، وإزالة الحديد، وإزالة الغازات الذائبة من المياه وتثبيتها.
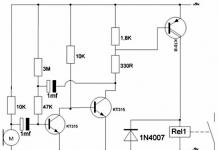
آلية عمل مثبطات IOMS.
عندما يتم تسخين الماء أثناء تشغيل نظام التدفئة، يحدث التحلل الحراري لأيونات البيكربونات الموجودة فيه مع تكوين أيونات الكربونات. تتفاعل أيونات الكربونات مع أيونات الكالسيوم الموجودة بكميات زائدة، وتشكل نواة بلورات كربونات الكالسيوم. يتم ترسيب المزيد والمزيد من أيونات الكربونات وأيونات الكالسيوم على سطح النوى، ونتيجة لذلك تتشكل بلورات كربونات الكالسيوم، والتي غالبًا ما توجد فيها كربونات المغنيسيوم في شكل محلول صلب بديل. تترسب هذه البلورات على جدران معدات التدفئة، وتنمو معًا لتشكل مقياسًا (الشكل 6، أ).
المكون الرئيسي الذي يضمن النشاط المضاد للتكلس لجميع المثبطات قيد النظر هو الفوسفونات العضوية - أملاح أحماض الفوسفونيك العضوية. عندما يتم إدخال الفوسفونات العضوية في الماء الذي يحتوي على أيونات الكالسيوم والمغنيسيوم ومعادن أخرى، فإنها تشكل مركبات كيميائية قوية جدًا - مجمعات. (تحتوي العديد من المثبطات الحديثة على الفوسفونات العضوية في شكل مجمعات تحتوي على معادن انتقالية، وخاصة الزنك.) نظرًا لأن لترًا واحدًا من المياه الطبيعية أو الصناعية يحتوي على 1020-1021 أيونات الكالسيوم والمغنيسيوم، ويتم إدخال الفوسفونات العضوية بكمية 1018-1019 جزيء فقط في كل مرة. لتر من الماء، تشكل جميع جزيئات الفوسفونات العضوية مجمعات تحتوي على أيونات معدنية، ولا توجد مجمعات في حد ذاتها في الماء. يتم امتصاص (ترسيب) مجمعات الفوسفونات العضوية على سطح نوى بلورات كربونات الكالسيوم، مما يمنع المزيد من تبلور كربونات الكالسيوم. لذلك، عند إضافة 1-10 جم/م3 من الفوسفونات العضوية إلى الماء، لا يتكون الترسبات الكلسية حتى عند تسخين الماء العسر جدًا (الشكل 6، ب).
مجمعات الفوسفونات العضوية قادرة على الامتصاص ليس فقط على سطح النوى البلورية، ولكن أيضًا على الأسطح المعدنية. الطبقة الرقيقة الناتجة تجعل من الصعب وصول الأكسجين إلى سطح المعدن، ونتيجة لذلك ينخفض معدل تآكل المعدن. ومع ذلك، فإن الحماية الأكثر فعالية للمعادن من التآكل يتم توفيرها من خلال مثبطات تعتمد على مجمعات من أحماض الفوسفونيك العضوية مع الزنك وبعض المعادن الأخرى، والتي تم تطويرها ووضعها موضع التنفيذ من قبل البروفيسور يو. كوزنتسوف. في الطبقة السطحية للمعدن، تكون هذه المركبات قادرة على التحلل لتكوين مركبات هيدروكسيد الزنك غير القابلة للذوبان، بالإضافة إلى مجمعات ذات بنية معقدة، والتي تشارك فيها العديد من ذرات الزنك والحديد. ونتيجة لذلك، يتم تشكيل فيلم رقيق كثيف، ملتصق بقوة بالمعدن، ويحمي المعدن من التآكل. يمكن أن تصل درجة حماية المعدن من التآكل عند استخدام هذه المثبطات إلى 98٪.
لا تمنع المستحضرات الحديثة المعتمدة على الفوسفونات العضوية رواسب الحجم والتآكل فحسب، بل تعمل أيضًا على تدمير الرواسب القديمة من منتجات الحجم والتآكل تدريجيًا. يتم تفسير ذلك من خلال تكوين طبقات الامتزاز السطحي للفوسفونات العضوية في مسام الحجم، والتي يختلف هيكلها وخصائصها (على سبيل المثال، معامل التمدد الحراري) عن هيكل بلورات المقياس. تؤدي التقلبات والتدرجات في درجات الحرارة التي تنشأ أثناء تشغيل نظام التسخين إلى تشابك الركام البلوري. ونتيجة لذلك، يتم تدمير المقياس، ويتحول إلى تعليق رفيع يمكن إزالته بسهولة من النظام. لذلك، عند إدخال المستحضرات المحتوية على الفوسفونات العضوية في أنظمة التدفئة التي تحتوي على كمية كبيرة من الرواسب القديمة ومنتجات التآكل، من الضروري تصريف الرواسب بانتظام من المرشحات ومجمعات الطين المثبتة في أدنى نقاط النظام. يجب تصريف الحمأة، اعتمادًا على كمية الرواسب، 1-2 مرات يوميًا، بناءً على تجديد النظام بالمياه النظيفة المعالجة بالمثبطات بمقدار 0.25-1% من حجم مياه النظام في الساعة. وتجدر الإشارة إلى أنه عندما يزيد تركيز المانع عن 10-20 جم/م3، يتم تدمير القشور مع تكوين معلقات خشنة جدًا يمكن أن تسد اختناقات نظام التدفئة. ولذلك، فإن جرعة زائدة من المانع في هذه الحالة تهدد بانسداد النظام. يتم تحقيق التنظيف الأكثر فعالية وأمانًا لأنظمة التدفئة من الرواسب القديمة ومنتجات التآكل باستخدام مستحضرات تحتوي على مواد خافضة للتوتر السطحي، على سبيل المثال، تركيبة KKF.
أ)  ب)
ب) 
أرز. 6. قسم خط أنابيب إمداد الماء الساخن 89 مم داخل الربع:
أ - بعد عامين من التشغيل على ماء بدرجة عسر 8-12 ملي مكافئ/دسم3؛
ب - ستة أشهر بعد بدء معالجة المياه بمثبط IOMS-1.
نحن نعلم من الإعلانات أن الماء العسر للغاية يؤدي إلى فشل واسع النطاق وسريع. غسالة ملابس. المصنعون لا يكذبون. الصلابة المفرطة لا تضر فقط الأجهزة المنزليةولكن أيضًا على الصحة: فهو يجعل الشعر رقيقًا وهشًا، ويسرع شيخوخة الجلد، ويعزز تطور أمراض الكلى والجهاز البولي التناسلي، ويخلق ضغطًا إضافيًا على الأوعية الدموية. اعتمادًا على الموقف، يمكنك تخفيف الماء طرق مختلفة، في هذه المقالة سوف نستعرض العلاجات المنزلية الأكثر بأسعار معقولة.
نظرية.صلابة الماء هي معلمة تميز تركيز أملاح الكالسيوم والمغنيسيوم في التركيبة. تقاس بوحدات مول / م 3 (مول لكل متر مكعب) أو درجات الصلابة (المقبولة في روسيا) - ملي مكافئ/لتر (ما يعادل مليجرام لكل لتر). وكلما ارتفع هذا المؤشر، كلما كان ذلك أسوأ.
وفقًا لبحث أجرته منظمة الصحة العالمية (WHO)، فإن عسر الماء الطبيعي هو 1-2 درجة فهرنهايت (ملجم-مكافئ/لتر). في روسيا، يعتبر المعيار المقبول هو ما يصل إلى 7 درجات فهرنهايت.
وينقسم الماء حسب عسره إلى:
- ناعم (0-2 درجة فهرنهايت) - يوجد في الطبيعة في مناطق المستنقعات مع مستنقعات الخث، كما يقع الثلج الذائب غير الملوث بمواد أخرى ضمن هذه المجموعة. ومن المثير للاهتمام أنه من الصعب جدًا غسل الصابون بالماء الناعم.
- متوسطة (2.1-7 درجة فهرنهايت) – الأكثر شيوعًا؛
- صلبة (7-10 درجات فهرنهايت) – ضارة بالصحة وخطرة؛
- شديد الصلابة (أكثر من 10 درجات فهرنهايت) - بوصة الظروف الطبيعيةتوجد في بحيرات الكهوف الكارستية، ومن المستحيل شرب مثل هذه المياه.
اعتمادا على المواد الموجودة، صلابة الماء هي:
- ثابت - ناتج عن وجود الكلوريدات والفوسفات والسيليكات والكبريتات ونترات المغنيسيوم والكالسيوم في الماء، والتي لا تتفكك أثناء الغليان، في الأساس، تتم إزالة هذه المواد فقط عن طريق المرشحات؛
- مؤقت - يحدث في معظم الحالات بسبب بيكربونات المغنيسيوم والكالسيوم التي تتحلل عند تسخينها وتشكل رواسب على الأنابيب وأجهزة التدفئة مما يؤدي إلى زيادة تكاليف الطاقة وأعطالها.
كيفية تحديد صلابة المياه
الخيار الأسهل هو إلقاء نظرة على خريطة خاصة لعسر المياه في منطقتك. يمكنك أيضًا استخدام مقياس التوصيل (مقياس TDS) - وهو جهاز خاص يقيس التوصيل الكهربائي للمياه، ويُطلق عليه شعبيًا "مقياس الملوحة". كلما زاد الرقم الموجود على الشاشة، زادت صعوبة الماء، لأنه يحتوي على الكثير من الأملاح. يمكن حساب النسبة الدقيقة من الجداول.

علامات زيادة عسر الماء:
- ينتج الصابون ومسحوق الغسيل كمية قليلة جدًا من الرغوة؛
- مقياس مستمر في الغلاية بعد عدة دمامل؛
- تظهر الخطوط بعد غسل الأطباق.
- الماء له طعم مرير قليلاً (لا يشعر به كل الناس) ؛
- وبعد الترسيب تظهر طبقة بيضاء على جدران أوعية الماء.
حاسبة تحويل وحدة صلابة المياه
°ZH (روسيا) °DH (ألمانيا) °كلارك (المملكة المتحدة) °F (فرنسا) ppm (الولايات المتحدة الأمريكية)
طرق تليين الماء
1. الغليان.أبسط طريقة بأسعار معقولةتخلص من الصلابة المؤقتة دون استخدام المواد الكيميائية والأجهزة المعقدة. في درجة حرارة عاليةتتحلل بيكربونات الكالسيوم والكبريتات لتشكل رواسب في قاع الأطباق و عناصر التدفئة. الماء المخفف مناسب لأي غرض: الشرب والغسيل والغسيل وما إلى ذلك.
يُغلى الماء ويُترك لمدة 2-3 دقائق ثم يُبرد إلى درجة الحرارة المطلوبة.
عيوب:
- يتم تقليل عسر الماء بشكل مؤقت فقط؛
- محدودة - لتوفير كافة احتياجات الأسرة ماء مغليصعب جدا؛
- بعد مرور بعض الوقت، بسبب طبقة الحجم، يجب تغيير أو تنظيف أنظمة التدفئة والحاويات؛
- يتبخر من الماء عندما يغلي مادة مفيدة;
- يتطلب التسخين إنفاقًا كبيرًا للطاقة.
2. الدعوة.بعد 1-2 يوم، في مكان محمي من أشعة الشمس المباشرة، يقوم بتخفيف الماء من الآبار والآبار المخصصة لسقي الزهور و النباتات الداخلية. يمكن استخدامه لتنقية مياه الشرب، ولكن فقط إذا كانت العسر الأولي أعلى قليلاً من المعتاد.
3. التجميد. طريقة فعالةالذي لا يغير بنية الماء، ونتيجة لذلك تبقى جميع المواد المفيدة في التركيبة. ضع الماء في الفريزر، وعندما يظهر الثلج على جوانب الوعاء، قم بتصريف السائل إلى أسفل المركز.
استخدم الثلج المذاب كمياه للشرب أو لسقي أواني الزهور.
العيب: من الصعب تحضير كميات كبيرة من الماء باستخدام هذه الطريقة.
4. الخبز ورماد الصودا.شكرا ل الخواص الكيميائيةتعمل صودا الخبز على تليين الماء وتقليل الحموضة.
أضف ملعقتين صغيرتين من صودا الخبز أو ملعقة صغيرة من رماد الصودا لكل 10 لترات من الماء، واخلطهما جيدًا وانتظر حتى تظهر الرواسب في القاع. عند الطهي، أضف ملعقة صغيرة من صودا الخبز إلى 3 لترات من الماء لمساعدة الحبوب والخضروات على الطهي بشكل أفضل.
عيوب:
- لا يمكن استخدام الماء المخفف بالصودا للشرب (باستثناء الغليان)؛
- صعوبة في معالجة كميات كبيرة من الماء باستمرار.
5. الخل وحمض الستريك.إنها تقلل جزئيًا من الصلابة، ولكنها تزيد الحموضة بشكل كبير، ونتيجة لذلك لا ينصح باستخدام هذه المنتجات لمياه الشرب. وغالبا ما تستخدم لأغراض التجميل.
لتنعيم ماء غسل الشعر، أضيفي ملعقة كبيرة من الخل (ملعقة صغيرة حمض الستريكأو عصير ليمونة واحدة) لكل 2 لتر من الماء مع التحريك. اتركيه لمدة 4-5 دقائق قبل الاستخدام.
6. الملح الصخري (المائدة).وهو أيضًا كلوريد الصوديوم الذي يعمل على إذابة أملاح الكالسيوم والمغنيسيوم الموجودة في الماء، مما يمنع ظهور الترسبات على أجهزة التدفئة. بسبب التغييرات التركيب الكيميائيوالطعم، ولا ينصح بهذه الطريقة للشرب.
في الأساس، الملح يخفف الماء المخصص له غسالات الصحون. لسهولة الاستخدام، توفر الشركات المصنعة الملح على شكل حبيبات وأقراص، ولكن في معظم الحالات لا يختلف تكوين المادة المقترحة عن ملح الطعام.
7. المواد الكيميائية.بادئ ذي بدء، هذه هي العلامات التجارية الشهيرة كالجون، فينيش وغيرها، والتي تباع في شكل مسحوق أو أقراص. استخدم وفقا للتعليمات. تباع في متاجر المواد الكيميائية المنزلية.
العيب: أنها تلين الماء فقط للغسيل.
8. المرشحات.أنظمة متعددة الاستخدامات مصممة للتليين السريع كمية كبيرةالماء العسر وإزالة الشوائب الضارة. يمكن أن تعمل بشكل مستقل أو تكون متصلة بإمدادات المياه. أنها تختلف في التصميم ومبدأ التشغيل.
أنواع أنظمة تقليل عسر المياه:
- إبريق التصفية– مصمم بحجم 1-3 لتر، مناسب لتنقية مياه الشرب وتحضير الشاي أو القهوة. تعمل باستخدام خرطوشة خاصة. اعتمادًا على شدة الاستخدام والصلابة الأولية للمياه، يستمر لمدة تصل إلى شهرين، ثم يتطلب الأمر استبدال خرطوشة الفلتر.
- أنظمة التبادل الأيوني– تصفية وتنعيم المياه مهما كانت عسرها باستخدام راتنجات التبادل الأيوني الخاصة والمحلول الملحي (توجد المواد في خزانات مختلفة). تتميز هذه المرشحات بالأداء العالي وسهولة الصيانة النسبية. العيوب: غير مناسب لمياه الشرب، ويتطلب الاستبدال الدوري للكواشف والتوصيل بالصرف الصحي.
- الرقائق المغناطيسية والكهرومغناطيسية– يتم تركيبها على الطرق السريعة أو على أنابيب المياه على شكل بطانات. تحت تأثير المغناطيسي أو حقل كهرومغناطيسيتفقد أملاح الصلابة قدرتها على الترسب على شكل حجم وتدفق إلى خزانات ترسيب خاصة. العيب: غير مناسب لتنقية مياه الشرب.