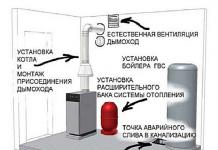
الكالسيوم
الكالسيوم-أنا؛ م.[من اللات. كالكس (كالسيس) - جير] عنصر كيميائي (Ca)، وهو معدن فضي أبيض اللون وهو جزء من الحجر الجيري والرخام وغيرها.
◁ كالسيوم اه اه أملاح ك.
الكالسيوم(lat. الكالسيوم)، العنصر الكيميائي للمجموعة الثانية الجدول الدورييشير إلى المعادن الأرضية القلوية. الاسم من اللات. كالكس, جينيتيفكالسيس - الجير. معدن فضي-أبيض، كثافته 1.54 جم/سم3، ر 842 درجة مئوية. في درجات الحرارة العادية يتأكسد بسهولة في الهواء. ومن حيث الانتشار في القشرة الأرضية فهو يحتل المرتبة الخامسة (معادن الكالسيت والجبس والفلوريت وغيرها). كعامل اختزال نشط، يتم استخدامه للحصول على U، Th، V، Cr، Zn، Be والمعادن الأخرى من مركباتها، لإزالة الأكسدة من الفولاذ والبرونز وما إلى ذلك. وهو جزء من المواد المضادة للاحتكاك. تستخدم مركبات الكالسيوم في البناء (الجير والأسمنت) وتستخدم مستحضرات الكالسيوم في الطب.
الكالسيومالكالسيوم (lat. كالسيوم)، Ca (اقرأ "الكالسيوم")، عنصر كيميائيبرقم ذري 20، يقع في الدورة الرابعة في المجموعة IIA من نظام مندليف الدوري للعناصر؛ الكتلة الذرية 40.08. ينتمي إلى العناصر الأرضية القلوية (سم.المعادن الأرضية القلوية).
يتكون الكالسيوم الطبيعي من خليط من النويدات (سم.نيوكليد)بأعداد كتلية 40 (في خليط بكتلة 96.94%)، 44 (2.09%)، 42 (0.667%)، 48 (0.187%)، 43 (0.135%) و 46 (0.003%). تكوين طبقة الإلكترون الخارجية 4 س 2
. في جميع المركبات تقريبًا، تكون حالة أكسدة الكالسيوم +2 (التكافؤ II).
يبلغ نصف قطر ذرة الكالسيوم المحايدة 0.1974 نانومتر، ونصف قطر أيون Ca 2+ يتراوح من 0.114 نانومتر (لرقم التنسيق 6) إلى 0.148 نانومتر (لرقم التنسيق 12). طاقات التأين المتسلسل لذرة الكالسيوم المحايدة هي، على التوالي، 6.133، 11.872، 50.91، 67.27 و 84.5 فولت. وفقًا لمقياس بولينج، تبلغ السالبية الكهربية للكالسيوم حوالي 1.0. في شكل حرالكالسيوم معدن أبيض فضي.
تاريخ الاكتشاف
توجد مركبات الكالسيوم في كل مكان في الطبيعة، لذلك عرفتها البشرية منذ القدم. منذ فترة طويلة يستخدم الجير في البناء (سم.جير)(الجير الحي والمطفأ)، والتي كانت تعتبر منذ فترة طويلة مادة بسيطة، "الأرض". ومع ذلك، في عام 1808 العالم الإنجليزي جي ديفي (سم.ديفي همفري)تمكنت من الحصول على معدن جديد من الجير. للقيام بذلك، تعرض ديفي للتحليل الكهربائي لخليط من الجير المطفأ المبلل قليلاً مع أكسيد الزئبق وعزل معدنًا جديدًا من الملغم المتكون على كاثود الزئبق، والذي أطلق عليه اسم الكالسيوم (من الكلس اللاتيني، جنس الكالسيس - الجير). في روسيا لبعض الوقت كان يسمى هذا المعدن "التجويف".
التواجد في الطبيعة
الكالسيوم هو أحد العناصر الأكثر شيوعًا على الأرض. وهو يمثل 3.38% من كتلة القشرة الأرضية (الخامس الأكثر وفرة بعد الأكسجين والسيليكون والألمنيوم والحديد). بسبب نشاطه الكيميائي العالي، لا يتواجد الكالسيوم بشكل حر في الطبيعة. تم العثور على معظم الكالسيوم في السيليكات (سم.السيليكات)والألومينوسيليكات (سم.سيليكات الألومنيوم)الصخور المختلفة (الجرانيت (سم.الجرانيت)النيس (سم.النيس)وما إلى ذلك وهلم جرا.). وفي صورة الصخور الرسوبية تتمثل مركبات الكالسيوم في الطباشير والحجر الجيري، وتتكون بشكل رئيسي من معدن الكالسيت (سم.الكالسيت)(كاكو 3). الشكل البلوري للكالسيت - الرخام - أقل شيوعًا في الطبيعة.
معادن الكالسيوم مثل الحجر الجيري شائعة جدًا (سم.حجر الكلس) CaCO3، الأنهيدريت (سم.الأنهيدريت) CaSO 4 والجبس (سم.جبس) CaSO4·2H2O، فلوريت (سم.الفلوريت)كاف 2، الأباتيت (سم.الأباتيت) Ca 5 (PO 4) 3 (F,Cl,OH)، الدولوميت (سم.الدولوميت) MgCO 3 · كربونات الكالسيوم 3 . إن وجود أملاح الكالسيوم والمغنيسيوم في المياه الطبيعية يحدد صلابتها (سم.عسر الماء). توجد كمية كبيرة من الكالسيوم في الكائنات الحية. وبالتالي، فإن هيدروكسيباتيت Ca 5 (PO 4) 3 (OH)، أو، في مدخل آخر، 3Ca 3 (PO 4) 2 · Ca(OH) 2، هو أساس النسيج العظمي للفقاريات، بما في ذلك البشر؛ تصنع الأصداف والأصداف للعديد من اللافقاريات وقشور البيض وما إلى ذلك من كربونات الكالسيوم CaCO 3.
إيصال
معدن الكالسيوميتم الحصول عليها عن طريق التحليل الكهربائي لمصهور يتكون من CaCl 2 (75-80٪) وKCl أو من CaCl 2 وCaF 2، بالإضافة إلى الاختزال الألوميني الحراري لـ CaO عند 1170-1200 درجة مئوية:
4CaO + 2Al = CaAl 2 O 4 + 3Ca.
الخصائص الفيزيائية والكيميائية
يوجد معدن الكالسيوم في شكلين من التعديلات المتآصلة (انظر المتآصلة (سم.التآصل)). حتى 443 درجة مئوية، تكون a-Ca مع شبكة مكعبة محورها الوجه (المعلمة a = 0.558 نانومتر) مستقرة؛ b-Ca مع شبكة مكعبة محورها الجسم من النوع a-Fe (المعلمة a = 0.448 نانومتر) تكون مستقرة. أكثر استقرارا. درجة انصهار الكالسيوم 839 درجة مئوية، ودرجة الغليان 1484 درجة مئوية، والكثافة 1.55 جم/سم3.
النشاط الكيميائي للكالسيوم مرتفع، ولكنه أقل من جميع المعادن الأرضية القلوية الأخرى. يتفاعل بسهولة مع الأكسجين وثاني أكسيد الكربون والرطوبة الموجودة في الهواء، ولهذا السبب عادة ما يكون سطح معدن الكالسيوم رماديًا باهتًا، لذلك يتم تخزين الكالسيوم في المختبر عادةً، مثل المعادن الأرضية القلوية الأخرى، في وعاء مغلق بإحكام تحت طبقة. من الكيروسين.
في سلسلة الجهود القياسية، يقع الكالسيوم على يسار الهيدروجين. جهد القطب القياسي لزوج Ca 2+ /Ca 0 هو –2.84 فولت، بحيث يتفاعل الكالسيوم بشكل نشط مع الماء:
Ca + 2H2O = Ca(OH)2 + H2.
يتفاعل الكالسيوم مع اللافلزات النشطة (الأكسجين، الكلور، البروم) في الظروف العادية:
2Ca + O 2 = 2CaO؛ Ca + Br2 = CaBr2.
عند تسخينه في الهواء أو الأكسجين، يشتعل الكالسيوم. يتفاعل الكالسيوم مع اللافلزات الأقل نشاطًا (الهيدروجين، البورون، الكربون، السيليكون، النيتروجين، الفوسفور وغيرها) عند تسخينه، على سبيل المثال:
Ca + H 2 = CaH 2 (هيدريد الكالسيوم)،
Ca + 6B = CaB 6 (بوريد الكالسيوم)،
3Ca + N 2 = Ca 3 N 2 (نيتريد الكالسيوم)
Ca + 2C = CaC2 (كربيد الكالسيوم)
3Ca + 2P = Ca 3 P 2 (فوسفيد الكالسيوم)، ومن المعروف أيضًا فوسفيدات الكالسيوم للتركيبات CaP وCaP 5؛
2Ca + Si = Ca 2 Si (مبيد سيليسيوم الكالسيوم)؛ ومن المعروف أيضًا أن مبيدات سيليسيوم الكالسيوم ذات التركيبات CaSi وCa 3 Si 4 وCaSi 2.
عادة ما يكون حدوث التفاعلات المذكورة أعلاه مصحوبًا بإطلاق كمية كبيرة من الحرارة (أي أن هذه التفاعلات طاردة للحرارة). في جميع المركبات التي تحتوي على اللافلزات، تكون حالة أكسدة الكالسيوم +2. معظم مركبات الكالسيوم مع اللافلزات تتحلل بسهولة بالماء، على سبيل المثال:
CaH 2 + 2H 2 O = Ca(OH) 2 + 2H 2،
Ca 3 N 2 + 3H 2 O = 3Ca(OH) 2 + 2NH 3.
أكسيد الكالسيوم عادة ما يكون أساسيا. يتم الحصول عليه في المختبر والتكنولوجيا عن طريق التحلل الحراري للكربونات:
كربونات الكالسيوم 3 = كربونات الكالسيوم + ثاني أكسيد الكربون 2.
يسمى أكسيد الكالسيوم التقني CaO بالجير الحي.
يتفاعل مع الماء لتكوين Ca(OH)2 ويطلق كمية كبيرة من الحرارة:
CaO + H2O = Ca(OH)2.
عادةً ما يُطلق على Ca(OH)2 الذي يتم الحصول عليه بهذه الطريقة اسم الجير المطفأ أو حليب الجير (سم.حليب الليمون)ويرجع ذلك إلى أن ذوبان هيدروكسيد الكالسيوم في الماء منخفض (0.02 مول/لتر عند 20 درجة مئوية)، وعند إضافته إلى الماء يتكون معلق أبيض.
عند تفاعله مع الأكاسيد الحمضية، يشكل CaO أملاحًا، على سبيل المثال:
CaO + CO 2 = CaCO 3؛ CaO + SO 3 = CaSO 4.
أيون Ca 2+ عديم اللون. عند إضافة أملاح الكالسيوم إلى اللهب، يتحول اللهب إلى اللون الأحمر القرميدي.
أملاح الكالسيوم مثل كلوريد CaCl 2 وبروميد CaBr 2 ويوديد CaI 2 ونترات الكالسيوم (NO 3) 2 شديدة الذوبان في الماء. غير قابلة للذوبان في الماء هي الفلورايد CaF 2، كربونات CaCO 3، كبريتات CaSO 4، متوسط أورثوفوسفات Ca 3 (PO 4) 2، أكسالات CaC 2 O 4 وبعض الآخرين.
ومن المهم، على عكس كربونات الكالسيوم المتوسطة CaCO 3، أن كربونات الكالسيوم الحمضية (بيكربونات) Ca(HCO 3) 2 قابلة للذوبان في الماء. في الطبيعة، وهذا يؤدي إلى العمليات التالية. عندما تخترق الأمطار الباردة أو مياه النهر المشبعة بثاني أكسيد الكربون تحت الأرض وتسقط على الحجر الجيري، يلاحظ ذوبانها:
كربونات الكالسيوم 3 + CO 2 + H 2 O = Ca(HCO 3) 2.
وفي نفس الأماكن التي يصعد فيها الماء المشبع ببيكربونات الكالسيوم إلى سطح الأرض ويتم تسخينه بفعل أشعة الشمس يحدث تفاعل عكسي:
Ca(HCO 3) 2 = CaCO 3 + CO 2 + H 2 O.
هذه هي الطريقة التي يتم بها نقل كميات كبيرة من المواد في الطبيعة. ونتيجة لذلك، يمكن أن تتشكل ثقوب ضخمة تحت الأرض (انظر كارست (سم.كارست (ظاهرة طبيعية))) ، وتتشكل "رقاقات ثلجية" حجرية جميلة - مقرنصات - في الكهوف (سم.الهوابط (التكوينات المعدنية))والصواعد (سم.الصواعد).
إن وجود بيكربونات الكالسيوم المذابة في الماء يحدد إلى حد كبير صلابة الماء المؤقتة. (سم.عسر الماء). ويسمى مؤقتا لأنه عندما يغلي الماء، تتحلل البيكربونات ويترسب كربونات الكالسيوم. تؤدي هذه الظاهرة، على سبيل المثال، إلى حقيقة أن الحجم يتشكل في الغلاية بمرور الوقت.
تطبيق الكالسيوم ومركباته
يستخدم معدن الكالسيوم في إنتاج اليورانيوم المعدني الحراري (سم.اليورانيوم (عنصر كيميائي))الثوريوم (سم.الثوريوم)التيتانيوم (سم.التيتانيوم (عنصر كيميائي))الزركونيوم (سم.الزركونيوم)السيزيوم (سم.السيزيوم)والروبيديوم (سم.الروبيديوم).
تستخدم مركبات الكالسيوم الطبيعية على نطاق واسع في إنتاج المواد الرابطة (الأسمنت (سم.يبني)الجبس (سم.جبس)، الجير، الخ). يعتمد التأثير الملزم للجير المطفأ على حقيقة أنه مع مرور الوقت، يتفاعل هيدروكسيد الكالسيوم مع ثاني أكسيد الكربون في الهواء. نتيجة للتفاعل المستمر، يتم تشكيل بلورات الكالسيت CaCO3 على شكل إبرة، والتي تنمو لتصبح أحجارًا وطوبًا ومواد بناء أخرى مجاورة، كما كانت، تلحمها في كل واحد. كربونات الكالسيوم البلورية - رخام - ناعم مواد التشطيب. يستخدم الطباشير لتبييض. يتم استهلاك كميات كبيرة من الحجر الجيري في إنتاج الحديد الزهر، لأنها تجعل من الممكن تحويل الشوائب المقاومة للحرارة لخام الحديد (على سبيل المثال، الكوارتز SiO 2) إلى خبث منخفض الذوبان نسبيًا.
التبييض فعال جدا كمطهر. (سم.مسحوق التبييض)- "المبيض" Ca(OCl)Cl - كلوريد مختلط وهيبوكلوريد الكالسيوم (سم.هيبوكلوريت الكالسيوم)مع قدرة أكسدة عالية.
كما تستخدم كبريتات الكالسيوم على نطاق واسع، فهي موجودة في شكل مركب لا مائي وفي شكل هيدرات بلورية - ما يسمى بالكبريتات "شبه المائية" - المرمر (سم.أليفيز فريزين (ميلانو)) CaSO 4 ·0.5H 2 O وثنائي هيدرات الكبريتات - الجبس CaSO 4 · 2H 2 O. يستخدم الجبس على نطاق واسع في البناء والنحت وتصنيع الجص والمنتجات الفنية المختلفة. يستخدم الجص أيضًا في الطب لتثبيت العظام أثناء الكسور.
يستخدم كلوريد الكالسيوم CaCl 2 مع ملح الطعام لمكافحة تجمد أسطح الطرق. فلوريد الكالسيوم CaF 2 مادة بصرية ممتازة.
الكالسيوم في الجسم
الكالسيوم هو عنصر حيوي (سم.العناصر الحيوية)، موجود باستمرار في أنسجة النباتات والحيوانات. عنصر مهم في عملية التمثيل الغذائي المعدني للحيوانات والبشر والتغذية المعدنية للنباتات، ويؤدي الكالسيوم وظائف مختلفة في الجسم. مكون من الأباتيت (سم.الأباتيت)بالإضافة إلى الكبريتات والكربونات، يشكل الكالسيوم المكون المعدني لأنسجة العظام. يحتوي جسم الإنسان الذي يزن 70 كجم على حوالي 1 كجم من الكالسيوم. يشارك الكالسيوم في عمل القنوات الأيونية (سم.القنوات الأيونية)نقل المواد عبر الأغشية البيولوجية في نقل النبضات العصبية (سم.الدافع العصبي)، في عمليات تخثر الدم (سم.جلطة دموية أو خثرة)والتخصيب. ينظم الكالسيفيرول استقلاب الكالسيوم في الجسم (سم.الكالسيفيرول)(فيتامين د). نقص أو زيادة الكالسيوم يؤدي إلى أمراض مختلفة - الكساح (سم.الكساح)التكلس (سم.التكلس)الخ لذلك يجب أن يكون غذاء الإنسان الكميات المطلوبةتحتوي على مركبات الكالسيوم (800-1500 ملغ من الكالسيوم يومياً). محتوى الكالسيوم مرتفع في منتجات الألبان (مثل الجبن والجبن والحليب) وبعض الخضروات وغيرها من الأطعمة. تستخدم مستحضرات الكالسيوم على نطاق واسع في الطب.
القاموس الموسوعي. 2009 .
المرادفات:تاريخ الكالسيوم
تم اكتشاف الكالسيوم عام 1808 على يد همفري ديفي، الذي حصل عن طريق التحليل الكهربائي للجير المطفأ وأكسيد الزئبق على ملغم الكالسيوم، نتيجة عملية تقطير الزئبق الذي بقي منه المعدن، والذي يسمى الكالسيوم.باللاتيني جيريبدو مثل كالكسوهذا هو الاسم الذي اختاره الكيميائي الإنجليزي للمادة المكتشفة.
الكالسيوم هو عنصر من عناصر المجموعة الفرعية الرئيسية الثانية من المجموعة الرابعة من الجدول الدوري للعناصر الكيميائية D.I. مندليف، لديه العدد الذري 20 والكتلة الذرية 40.08. التسمية المقبولة هي Ca (من اللاتينية - الكالسيوم).
الخصائص الفيزيائية والكيميائية
الكالسيوم هو معدن قلوي ناعم متفاعل ذو لون أبيض فضي. بسبب التفاعل مع الأكسجين وثاني أكسيد الكربون، يصبح سطح المعدن باهتا، لذلك يتطلب الكالسيوم نظام تخزين خاص - حاوية مغلقة بإحكام، حيث يتم ملء المعدن بطبقة من البارافين السائل أو الكيروسين.
الكالسيوم هو أشهر العناصر الدقيقة الضرورية للإنسان، ويتراوح الاحتياج اليومي منه من 700 إلى 1500 ملجم للشخص البالغ السليم، ولكنه يزداد خلال فترة الحمل والرضاعة، ويجب أخذ ذلك بعين الاعتبار ويجب الحصول على الكالسيوم من خلاله. شكل الاستعدادات.

التواجد في الطبيعة
يمتلك الكالسيوم نشاطًا كيميائيًا عاليًا جدًا، لذلك لا يوجد في الطبيعة بشكله الحر (النقي). إلا أنه يحتل المرتبة الخامسة من حيث الانتشار في القشرة الأرضية؛ ويوجد على شكل مركبات في المواد الرسوبية (الحجر الجيري والطباشير) والصخور (الجرانيت)؛ ويحتوي أنوريت الفلسبار على الكثير من الكالسيوم.
وهو منتشر بشكل كبير في الكائنات الحية، وقد وجد وجوده في النباتات والحيوانات والإنسان، حيث يتواجد بشكل رئيسي في الأسنان والأنسجة العظمية.

امتصاص الكالسيوم
من العوائق التي تحول دون الامتصاص الطبيعي للكالسيوم من الطعام تناول الكربوهيدرات على شكل حلويات وقلويات تعمل على تحييد حمض الهيدروكلوريك في المعدة الضروري لإذابة الكالسيوم. إن عملية امتصاص الكالسيوم معقدة للغاية، لذلك في بعض الأحيان لا يكفي الحصول عليها من الطعام فقط، فمن الضروري تناول كميات إضافية من العناصر الدقيقة.
التفاعل مع الآخرين
لتحسين امتصاص الكالسيوم في الأمعاء، فهو ضروري، مما يؤدي إلى تسهيل عملية امتصاص الكالسيوم. عند تناول الكالسيوم (على شكل مكملات) أثناء الأكل، يتم منع امتصاصه، لكن تناول مكملات الكالسيوم بشكل منفصل عن الطعام لا يؤثر على هذه العملية بأي شكل من الأشكال.
يوجد كل الكالسيوم الموجود في الجسم تقريبًا (من 1 إلى 1.5 كجم) في العظام والأسنان. ويشارك الكالسيوم في عمليات استثارة الأنسجة العصبية وانقباض العضلات وعمليات تخثر الدم، وهو جزء من نواة وأغشية الخلايا والسوائل الخلوية والأنسجة، وله تأثيرات مضادة للحساسية ومضادة للالتهابات، ويمنع الحماض، وينشط عدد الانزيمات والهرمونات. ويشارك الكالسيوم أيضًا في تنظيم نفاذية غشاء الخلية وله تأثير معاكس.

علامات نقص الكالسيوم
من علامات نقص الكالسيوم في الجسم ما يلي، للوهلة الأولى، أعراض غير ذات صلة:
- العصبية وتدهور الحالة المزاجية.
- راحة القلب.
- التشنجات وخدر الأطراف.
- تباطؤ النمو والأطفال.
- ضغط دم مرتفع؛
- تقسيم وهشاشة الأظافر.
- آلام المفاصل، وخفض "عتبة الألم"؛
- الحيض الثقيل.
أسباب نقص الكالسيوم
قد تشمل أسباب نقص الكالسيوم الأنظمة الغذائية غير المتوازنة (خاصة الصيام)، وانخفاض محتوى الكالسيوم في الطعام، والتدخين والإدمان على القهوة والمشروبات التي تحتوي على الكافيين، وعسر العاج، وأمراض الكلى، وأمراض الغدة الدرقية، والحمل، والرضاعة، وانقطاع الطمث.
يتميز الكالسيوم الزائد، والذي يمكن أن يحدث مع الاستهلاك المفرط لمنتجات الألبان أو الاستخدام غير المنضبط للأدوية، بالعطش الشديد والغثيان والقيء وفقدان الشهية والضعف وزيادة التبول.

استخدامات الكالسيوم في الحياة
وقد وجد الكالسيوم تطبيقا في إنتاج اليورانيوم المعدني الحراري، في شكل مركبات طبيعية يستخدم كمادة خام لإنتاج الجبس والأسمنت، كوسيلة للتطهير (المعروف). مبيض).
مركبات الكالسيوم.
ساو– أكسيد الكالسيوم أو الجير الحي، الناتج عن تحلل الحجر الجيري: CaCO 3 = CaO + CO 2 هو أكسيد معدن ترابي قلوي، لذلك يتفاعل بنشاط مع الماء: CaO + H 2 O = Ca (OH) 2
كاليفورنيا (أوه) 2 – هيدروكسيد الكالسيوم أو الجير المطفأ، لذلك يسمى التفاعل CaO + H 2 O = Ca(OH) 2 بإطفاء الجير. وإذا تم ترشيح المحلول تكون النتيجة ماء الجير - وهذا محلول قلوي، فيتغير لون الفينول فثالين إلى اللون القرمزي.
يستخدم الجير المطفأ على نطاق واسع في البناء. ويعتبر خليطه مع الرمل والماء مادة رابطة جيدة. تحت تأثير ثاني أكسيد الكربون، يتصلب الخليط Ca(OH) 2 + CO 2 = CaCO3 + H 2 O.
وفي نفس الوقت يتحول جزء من الرمل والخليط إلى سيليكات Ca(OH) 2 + SiO 2 = CaSiO 3 + H 2 O.
تلعب المعادلات Ca (OH) 2 + CO 2 = CaCO 2 + H 2 O و CaCO 3 + H 2 O + CO 2 = Ca (HCO 3) 2 دورًا كبيرًا في الطبيعة وفي تشكيل مظهر كوكبنا. ثاني أكسيد الكربون على هيئة نحات ومعماري يخلق قصوراً تحت الأرض في طبقات الصخور الكربونية. إنها قادرة على نقل مئات وآلاف الأطنان من الحجر الجيري تحت الأرض. من خلال الشقوق في الصخور، يدخل الماء المذاب فيه ثاني أكسيد الكربون إلى طبقة الحجر الجيري، ويشكل تجاويف - كهوف العجلات. بيكربونات الكالسيوم موجودة فقط في المحلول. المياه الجوفيةيتحرك في القشرة الأرضية ويتبخر الماء تحت ظروف مناسبة: Ca(HCO3) 2 = CaCO3 + H2O + ثاني أكسيد الكربون 2 , هذه هي الطريقة التي تتشكل بها الهوابط والصواعد ، والتي اقترح عالم الكيمياء الجيولوجية الشهير أ. فيرمان. يوجد الكثير من كهوف كاستروم في شبه جزيرة القرم. العلم يدرسهم دراسة المغاور.
كربونات الكالسيوم المستخدمة في البناء كربونات الكالسيوم 3- الطباشير والحجر الجيري والرخام. لقد رأيتم جميعًا محطة السكك الحديدية لدينا: وهي مزينة بالرخام الأبيض الذي تم جلبه من الخارج.
خبرة:تنفخ من خلال أنبوب في محلول ماء الجير، يصبح غائما .
كاليفورنيا (أوه) 2 + شركة 2 = كربونات الكالسيوم 3 + ن 2 عن
يضاف حمض الأسيتيك إلى الراسب المتكون ويلاحظ الغليان لأنه يتم إطلاق ثاني أكسيد الكربون.
كربونات الكالسيوم 3 +2CH 3 COOH = Ca(CH 3 سو) 2 +ح 2 او + كو 2
حكاية إخوة الكربونات.
ثلاثة إخوة يعيشون على الأرض
من عائلة الكربونات.
الأخ الأكبر هو ماربل وسيم،
مجيد باسم كرارة,
مهندس معماري ممتاز. هو
بنيت روما والبارثينون.
الجميع يعرف الحجر الجيري،
ولهذا السبب سمي بهذا الشكل.
مشهور بعمله
بناء منزل خلف المنزل.
كلا قادراً وقادراً
الأخ الصغير الناعم ميل.
انظروا كيف يرسم،
هذا كربونات الكالسيوم 3!
الإخوة يحبون المرح
ندخلها فرن ساخن،
ثم يتم تشكيل CaO وCO 2.
هذا هو ثاني أكسيد الكربون
كل واحد منكم يعرفه ،
نحن نزفرها.
حسنا، هذا هو SaO -
الجير الحي الساخن المحترق.
أضيفي إليه الماء،
تخلط جيدا
حتى لا يكون هناك أي مشكلة،
نحن نحمي أيدينا
ليمون عجن جيداً، لكنه مقطّع!
حليب بالليمون
يتم تبييض الجدران بسهولة.
أصبح البيت المشرق مبتهجا،
تحويل الجير إلى الطباشير.
الخزعبلات للشعب:
عليك فقط أن تنفخ في الماء،
كم هو سهل
تحولت إلى حليب!
والآن أصبح الأمر ذكيًا جدًا
أحصل على الصودا:
الحليب بالإضافة إلى الخل. نعم!
الرغوة تتدفق على الحافة!
كل شيء في الهموم، كل شيء في العمل
من الفجر إلى الفجر -
هؤلاء الإخوة كربونات،
هذه CaCO 3!
تكرار:
تساو- أكسيد الكالسيوم، الجير الحي؛
كاليفورنيا (أوه) 2
– هيدروكسيد الكالسيوم (الجير المطفأ، ماء الجير، حليب الجير حسب تركيز المحلول).
الشيء العام هو نفس الصيغة الكيميائية Ca(OH)2. الفرق: ماء الجير هو محلول شفاف مشبع من Ca(OH) 2، وحليب الجير عبارة عن معلق أبيض من Ca(OH) 2 في الماء.
كاكل 2
- كلوريد الكالسيوم، كلوريد الكالسيوم.
كربونات الكالسيوم 3
– كربونات الكالسيوم، الطباشير، الرخام الصدفي، الحجر الجيري.
L/R: المجموعات.بعد ذلك، نعرض مجموعة من المعادن المتوفرة في مختبر المدرسة: الحجر الجيري، الطباشير، الرخام، الصخور الصدفية.
CaS0 4
∙ ساعتان 2
0
- هيدرات كريستال كبريتات الكالسيوم والجبس.
كربونات الكالسيوم 3
- الكالسيت، وكربونات الكالسيوم جزء من العديد من المعادن التي تغطي مساحة 30 مليون كيلومتر مربع على الأرض.
وأهم هذه المعادن حجر الكلس. الصخور الصدفية والحجر الجيري من أصل عضوي. يتم استخدامه في إنتاج الأسمنت وكربيد الكالسيوم والصودا وجميع أنواع الجير وفي صناعة المعادن. الحجر الجيري هو أساس صناعة البناء، حيث تُصنع منه العديد من مواد البناء.
الطباشيرلا يقتصر الأمر على مسحوق الأسنان والطباشير المدرسية. يعد هذا أيضًا مادة مضافة قيمة في إنتاج الورق (المطلي - اعلى جودة) والمطاط. في تشييد وتجديد المباني - كتبييض.
الرخام صخرة بلورية كثيفة. يوجد لون أبيض اللون ، ولكن في أغلب الأحيان تلونه الشوائب المختلفة بألوان مختلفة. الرخام الأبيض النقي نادر ويستخدم بشكل رئيسي في أعمال النحاتين (تماثيل مايكل أنجلو ورودان. في البناء، يتم استخدام الرخام الملون كمواد مواجهة (مترو موسكو) أو حتى كمادة رئيسية مواد بناءقصور (تاج محل).
في عالم الأشياء المثيرة للاهتمام “ضريح تاج محل”
أبقى شاه جاهان، من سلالة المغول العظمى، كل آسيا تقريبًا في حالة خوف وطاعة. في عام 1629، توفيت ممزة محل، زوجة شاه جاهان المحبوبة، عن عمر يناهز 39 عامًا أثناء ولادة إحدى الحملات (كان هذا طفلهما الرابع عشر، وجميعهم من الذكور). كانت جميلة بشكل غير عادي، مشرقة، ذكية، أطاعها الإمبراطور في كل شيء. قبل وفاتها طلبت من زوجها بناء قبر ورعاية الأطفال وعدم الزواج. أرسل الملك الحزين مبعوثيه للجميع المدن الكبرى، عواصم الدول المجاورة - إلى بخارى وسمرقند وبغداد ودمشق من أجل العثور على أفضل الحرفيين ودعوتهم - تخليداً لذكرى زوجته قرر الملك تشييد أفضل مبنى في العالم. وفي الوقت نفسه، أرسل الرسل خططًا لأفضل المباني في آسيا وأفضل مواد البناء إلى أغرا (الهند). حتى أنهم أحضروا الملكيت من روسيا وجزر الأورال. جاء رؤساء البنائين من دلهي وقندهار. المهندسين المعماريين - من اسطنبول، سمرقند؛ مصممو الديكور - من بخارى؛ البستانيون - من البنغال؛ وكان الفنانون من دمشق وبغداد، وكان الأستاذ المشهور أستاذ عيسى هو المسؤول.
معًا، على مدار أكثر من 25 عامًا، تم بناء هيكل من الرخام الطباشيري محاطًا بالحدائق الخضراء والنوافير الزرقاء ومسجد من الحجر الرملي الأحمر. قام 20 ألف عبد بتشييد هذه المعجزة التي يبلغ ارتفاعها 75 مترًا (مبنى مكون من 25 طابقًا). وفي مكان قريب كنت أرغب في بناء ضريح ثان لنفسي من الرخام الأسود، لكن لم يكن لدي الوقت. أطاح به ابنه (الثاني) من العرش وقتل أيضًا جميع إخوته.
قضى حاكم أغرا وسيدها السنوات الأخيرة من حياته وهو ينظر من النافذة الضيقة لسجنه. لمدة 7 سنوات، أعجب والدي بإبداعه. عندما أصيب الأب بالعمى، صنع له الابن نظامًا من المرايا حتى يتمكن الأب من الإعجاب بالضريح. ودفن في تاج محل بجوار ممتازه.
أولئك الذين يدخلون الضريح يرون التابوت - مقابر زائفة. تقع أماكن الراحة الأبدية للخان العظيم وزوجته في الطابق السفلي. كل شيء هناك مرصع بالأحجار الكريمة التي تتوهج كما لو كانت حية، وأغصان الأشجار الخيالية المتشابكة مع الزهور تزين جدران المقبرة بأنماط معقدة. تم صناعتها على يد أفضل النحاتين، حيث يحتفل اللازورد الأزرق الفيروزي واليشم الأخضر والأسود والجمشت الأحمر بحب شاه جاهال وممزات محل.
يندفع السياح كل يوم إلى أغرا، راغبين في رؤية الحقيقة عجائب الدنيا - ضريح تاج محل، كما لو كانت تطفو فوق الأرض.
كربونات الكالسيوم 3 هي مادة بناء للهيكل الخارجي للرخويات والشعاب المرجانية والأصداف وغيرها، وقشور البيض. (الرسوم التوضيحية أو "حيوانات التكاثر الحيوي المرجاني" وعرض مجموعة من المرجان البحري والإسفنج والصخور الصدفية).
الكالسيوم(الكالسيوم)، Ca، العنصر الكيميائي للمجموعة الثانية من النظام الدوري لمندليف، العدد الذري 20، الكتلة الذرية 40.08؛ معدن خفيف أبيض فضي. العنصر الطبيعي عبارة عن خليط من ستة نظائر مستقرة: 40 Ca، 42 Ca، 43 Ca، 44 Ca، 46 Ca و48 Ca، منها 40 Ca هو الأكثر وفرة (96، 97٪).
مركبات الكالسيوم - الحجر الجيري والرخام والجبس (وكذلك الجير - منتج تكلس الحجر الجيري) كانت تستخدم بالفعل في البناء في العصور القديمة. حتى نهاية القرن الثامن عشر، كان الكيميائيون يعتبرون الجير مادة صلبة بسيطة. في عام 1789، اقترح أ. لافوازييه أن الجير والمغنيسيا والباريت والألومينا والسيليكا هي مواد معقدة. في عام 1808، قام جي ديفي، بإخضاع خليط من الجير المطفأ الرطب مع أكسيد الزئبق للتحليل الكهربائي باستخدام كاثود الزئبق، بإعداد ملغم Ca، ومن خلال تقطير الزئبق منه، حصل على معدن يسمى "الكالسيوم" (من الكلمة اللاتينية calx، كالسيس بين الجنسين - الجير).
توزيع الكالسيوم في الطبيعة.من حيث الوفرة في القشرة الأرضية، يحتل الكالسيوم المرتبة الخامسة (بعد O وSi وAl وFe)؛ محتوى 2.96% بالوزن. يهاجر بقوة ويتراكم في مختلف الأنظمة الجيوكيميائية مكونًا 385 معدنًا (المركز الرابع في عدد المعادن). يوجد القليل من الكالسيوم في وشاح الأرض وربما أقل في باطن الأرض (0.02% في النيازك الحديدية). يسود الكالسيوم في الجزء السفلي من القشرة الأرضية، ويتراكم في الصخور الرئيسية؛ معظم الكالسيوم موجود في الفلسبار - Ca anorthite؛ المحتوى في الصخور القاعدية 6.72%، وفي الصخور الحمضية (الجرانيت وغيرها) 1.58%. في المحيط الحيوي، يحدث تمايز حاد بشكل استثنائي لـ Ca، يرتبط بشكل أساسي بـ "توازن الكربونات": عندما يتفاعل ثاني أكسيد الكربون مع كربونات CaCO 3، تتشكل بيكربونات Ca(HCO 3) 2 القابلة للذوبان: CaCO 3 + H 2 O + CO 2 = Ca(HCO 3) 2 = Ca 2+ + 2HCO 3- . هذا التفاعل قابل للعكس وهو أساس إعادة توزيع الكالسيوم. عندما يكون محتوى ثاني أكسيد الكربون في المياه مرتفعًا، يكون الكالسيوم في محلول، وعندما يكون محتوى ثاني أكسيد الكربون منخفضًا، يترسب معدن الكالسيت CaCO 3، مكونًا رواسب سميكة من الحجر الجيري والطباشير والرخام.
تلعب الهجرة الحيوية أيضًا دورًا كبيرًا في تاريخ الكالسيوم. في المادة الحية للعناصر المعدنية، Ca هو العنصر الرئيسي. من المعروف أن الكائنات الحية تحتوي على أكثر من 10٪ من الكالسيوم (المزيد من الكربون)، وبناء هيكلها العظمي من مركبات الكالسيوم، وخاصة من كربونات الكالسيوم 3 (الطحالب الجيرية، والعديد من الرخويات، وشوكيات الجلد، والمرجان، والجذور، وما إلى ذلك). مع دفن الهياكل العظمية في البحر. ترتبط الحيوانات والنباتات بتراكم الكتل الهائلة من الطحالب والمرجان والأحجار الجيرية الأخرى التي تغوص في أعماق الأرض وتتمعدن وتتحول إلى أنواع مختلفةرخام.
تتميز المناطق الشاسعة ذات المناخ الرطب (مناطق الغابات والتندرا) بنقص الكالسيوم - وهنا يتم ترشيحه بسهولة من التربة. ويرتبط ذلك بانخفاض خصوبة التربة، وانخفاض إنتاجية الحيوانات الأليفة، وصغر حجمها، وأمراض الهيكل العظمي في كثير من الأحيان. لهذا أهمية عظيمةيحتوي على تكلس التربة وتغذية الحيوانات الأليفة والطيور وما إلى ذلك. على العكس من ذلك، في المناخات الجافة يصعب ذوبان CaCO 3، وبالتالي فإن المناظر الطبيعية في السهوب والصحاري غنية بالكالسيوم. في المستنقعات المالحة والبحيرات المالحة، يتراكم الجبس CaSO 4 · 2H 2 O غالبًا.
تجلب الأنهار الكثير من الكالسيوم إلى المحيط، لكنها لا تبقى في مياه المحيط (متوسط المحتوى 0.04٪)، ولكنها تتركز في الهياكل العظمية للكائنات الحية، وبعد وفاتها، تترسب في القاع بشكل رئيسي في شكل كربونات الكالسيوم. 3. ينتشر الطمي الجيري على نطاق واسع في قاع جميع المحيطات على أعماق لا تزيد عن 4000 متر (في الأعماق الأكبر يذوب CaCO 3، وغالبًا ما تعاني الكائنات الحية هناك من نقص الكالسيوم).
تلعب المياه الجوفية دورًا مهمًا في هجرة الكالسيوم. في كتل الحجر الجيري، في بعض الأماكن، يتم ترشيح CaCO 3 بقوة، والذي يرتبط بتطور الكارست، وتكوين الكهوف والهوابط والصواعد. بالإضافة إلى الكالسيت، في بحار العصور الجيولوجية الماضية، كان هناك ترسب واسع النطاق لفوسفات الكالسيوم (على سبيل المثال، رواسب كاراتاو الفوسفوريت في كازاخستان)، والدولوميت CaCO 3 ·MgCO 3، وفي البحيرات أثناء التبخر - الجبس.
على مدار التاريخ الجيولوجي، زاد تكوين الكربونات الحيوية وانخفض الترسيب الكيميائي للكالسيت. في بحار ما قبل الكمبري (منذ أكثر من 600 مليون سنة) لم تكن هناك حيوانات ذات هياكل عظمية كلسية؛ لقد أصبحت منتشرة على نطاق واسع منذ العصر الكمبري (الشعاب المرجانية، والإسفنج، وما إلى ذلك). ويرتبط هذا بالمحتوى العالي من ثاني أكسيد الكربون في جو عصر ما قبل الكمبري.
الخصائص الفيزيائية للكالسيوم.الشبكة البلورية للشكل α Ca (مستقرة عند درجات الحرارة العادية) هي مكعبة مركزية الوجه، و= 5.56 Å. نصف القطر الذري 1.97 أنجستروم، ونصف القطر الأيوني Ca 2+ 1.04 أنجستروم. الكثافة 1.54 جم/سم3 (20 درجة مئوية). فوق 464 درجة مئوية، يكون الشكل السداسي مستقرًا. تذوب عند 851 درجة مئوية، وتغلي عند 1482 درجة مئوية؛ معامل درجة الحرارة للتمدد الخطي 22·10 -6 (0-300 درجة مئوية)؛ الموصلية الحرارية عند 20 درجة مئوية 125.6 وات/(م كلفن) أو 0.3 كالوري/(سم ثانية درجة مئوية)؛ السعة الحرارية النوعية (0-100 درجة مئوية) 623.9 جول/(كجم كلفن) أو 0.149 كالوري/(جم درجة مئوية)؛ المقاومة الكهربائية عند 20 درجة مئوية 4.6·10 -8 أوم·م أو 4.6·10 -6 أوم·سم؛ معامل درجة الحرارة للمقاومة الكهربائية هو 4.57·10 -3 (20 درجة مئوية). معامل المرونة 26 جيجا نيوتن/م2 (2600 كجم قوة/مم2)؛ قوة الشد 60 مليون نيوتن/م2 (6 كجم قوة/مم2)؛ حد المرونة 4 مليون نيوتن/م2 (0.4 كجم قوة/مم2)، قوة الخضوع 38 مليون نيوتن/م2 (3.8 كجم قوة/مم2)؛ استطالة نسبية 50%؛ صلابة برينل 200-300 مليون/م2 (20-30 كجم/مم2). الكالسيوم ذو درجة نقاء عالية بما فيه الكفاية هو عبارة عن بلاستيك، يسهل ضغطه، ولفه، وقابل للقطع.
الخواص الكيميائية للكالسيوم.تكوين الغلاف الإلكتروني الخارجي لذرة Ca 4s 2، والذي بموجبه يكون Ca في المركبات ثنائي التكافؤ. كيميائيا، الكالسيوم نشط جدا. في درجات الحرارة العادية، يتفاعل الكالسيوم بسهولة مع الأكسجين والرطوبة الموجودة في الهواء، لذلك يتم تخزينه في حاويات محكمة الغلق أو تحت الزيوت المعدنية. عند تسخينه في الهواء أو الأكسجين، فإنه يشتعل ليعطي الأكسيد الأساسي CaO. ومن المعروف أيضًا أن البيروكسيدات Ca - CaO 2 و CaO 4. يتفاعل الكالسيوم بسرعة مع الماء البارد في البداية، ثم يتباطأ التفاعل بسبب تكوين طبقة Ca(OH)2. يتفاعل Ca بقوة مع الماء الساخنوالأحماض، مطلقة H2 (باستثناء HNO3 المركز). يتفاعل مع الفلور في البرد، ومع الكلور والبروم - فوق 400 درجة مئوية، مما يعطي CaF 2 وCaCl 2 وCaBr 2 على التوالي. في الحالة المنصهرة، تشكل هذه الهاليدات ما يسمى بالمركبات الفرعية مع Ca - CaF، CaCl، حيث يكون Ca أحادي التكافؤ رسميًا. عندما يتم تسخين Ca مع الكبريت، يتم الحصول على كبريتيد الكالسيوم CaS، ويضيف الأخير الكبريت، ويشكل polysulfides (CaS 2، CaS 4 وغيرها). بالتفاعل مع الهيدروجين الجاف عند درجة حرارة 300-400 درجة مئوية، يشكل الكالسيوم هيدريد CaH 2 - وهو مركب أيوني يكون فيه الهيدروجين أنيونًا. عند 500 درجة مئوية، يعطي الكالسيوم والنيتروجين نيتريد Ca 3 N 2؛ تفاعل الكالسيوم مع الأمونيا في البرد يؤدي إلى الأمونيا المعقدة Ca 6. عند تسخينه دون وصول الهواء باستخدام الجرافيت أو السيليكون أو الفوسفور، يعطي Ca، على التوالي، كربيد الكالسيوم CaC 2 ومبيدات السيليكات Ca 2 Si وCaSi وCaSi 2 والفوسفيد Ca 3 P 2. يشكل الكالسيوم مركبات بين المعادن مع Al وAg وAu وCu وLi وMg وPb وSn وغيرها.
الحصول على الكالسيوم.في الصناعة، يتم الحصول على الكالسيوم بطريقتين: 1) عن طريق تسخين خليط من قوالب الكالسيوم ومسحوق آل عند 1200 درجة مئوية في فراغ من 0.01-0.02 ملم زئبق. فن.؛ يتحرر بواسطة التفاعل: 6CaO + 2 Al = 3CaO·Al 2 O 3 + 3Ca Ca تتكثف الأبخرة على سطح بارد؛ 2) عن طريق التحليل الكهربائي لصهر CaCl 2 وKCl مع كاثود النحاس والكالسيوم السائل، يتم تحضير سبيكة Cu - Ca (65% Ca)، والتي يتم تقطير Ca منها عند درجة حرارة 950-1000 درجة مئوية في الفراغ. من 0.1-0.001 ملم زئبق. فن.
تطبيق الكالسيوم.في شكل معدن نقي، يتم استخدام Ca كعامل اختزال لـ U، Th، Cr، V، Zr، Cs، Rb وبعض المعادن الأرضية النادرة من مركباتها. كما أنه يستخدم لإزالة الأكسدة من الفولاذ والبرونز والسبائك الأخرى، لإزالة الكبريت من المنتجات البترولية، لتجفيف السوائل العضوية، لتنقية الأرجون من شوائب النيتروجين وكممتص للغاز في أجهزة التفريغ الكهربائية. تم استخدام المواد المضادة للاحتكاك لنظام Pb-Na-Ca، وكذلك سبائك Pb-Ca المستخدمة في تصنيع الأصداف الكهربائية، على نطاق واسع في التكنولوجيا. الكابلات يتم استخدام سبيكة Ca-Si-Ca (سيليكوكالسيوم) كمزيل للأكسدة ومزيل الغازات في إنتاج الفولاذ عالي الجودة.
الكالسيوم في الجسم .كا هو واحد من العناصر الغذائيةضرورية للسير الطبيعي لعمليات الحياة. وهو موجود في جميع أنسجة وسوائل الحيوانات والنباتات. الكائنات الحية النادرة فقط هي التي يمكنها التطور في بيئة خالية من الكالسيوم. يصل محتوى الكالسيوم في بعض الكائنات الحية إلى 38%؛ في البشر - 1.4-2٪. تتطلب خلايا الكائنات النباتية والحيوانية نسبًا محددة بدقة من أيونات Ca 2+ وNa + وK + في البيئات خارج الخلية. تحصل النباتات على الكالسيوم من التربة. بناءً على علاقتها بالكالسيوم، تنقسم النباتات إلى كالسيفيل وكالسيفوبي. تحصل الحيوانات على الكالسيوم من الغذاء والماء. الكالسيوم ضروري لتكوين عدد من الهياكل الخلوية، والحفاظ على النفاذية الطبيعية لأغشية الخلايا الخارجية، ولتخصيب بيض الأسماك والحيوانات الأخرى، وتنشيط عدد من الإنزيمات. تنقل أيونات Ca 2+ الإثارة إلى الألياف العضلية، مما يؤدي إلى انقباضها، وزيادة قوة انقباضات القلب، وزيادة وظيفة البلعمة للكريات البيضاء، وتنشيط نظام بروتينات الدم الواقية، والمشاركة في تخثره. في الخلايا، يتم العثور على كل الكالسيوم تقريبًا في شكل مركبات تحتوي على بروتينات وأحماض نووية وفوسفوليبيدات وفي مجمعات تحتوي على فوسفات غير عضوي وأحماض عضوية. في بلازما الدم لدى البشر والحيوانات العليا، يمكن ربط 20-40٪ فقط من الكالسيوم بالبروتينات. في الحيوانات ذات الهيكل العظمي، يتم استخدام ما يصل إلى 97-99٪ من إجمالي الكالسيوم كمواد بناء: في اللافقاريات بشكل رئيسي على شكل CaCO 3 (أصداف الرخويات والشعاب المرجانية)، في الفقاريات - على شكل فوسفات. تقوم العديد من اللافقاريات بتخزين الكالسيوم قبل طرح الريش لبناء هيكل عظمي جديد أو لضمان الوظائف الحيوية في الظروف غير المواتية.
يتم تنظيم محتوى الكالسيوم في دم البشر والحيوانات العليا بواسطة هرمونات الغدة الدرقية والغدة الدرقية. ويلعب فيتامين د دورًا رئيسيًا في هذه العمليات، ويتم امتصاص الكالسيوم في الجزء الأمامي من الأمعاء الدقيقة. يتدهور امتصاص الكالسيوم مع انخفاض حموضة الأمعاء ويعتمد على نسبة الكالسيوم والفسفور والدهون في الطعام. تبلغ النسبة المثالية لـ Ca/P في حليب البقر حوالي 1.3 (في البطاطس 0.15، في الفول 0.13، في اللحوم 0.016). إذا كان هناك فائض من P في الطعام أو حمض الأكساليكامتصاص الكالسيوم ضعيف. تعمل الأحماض الصفراوية على تسريع امتصاصه. النسبة المثالية للكالسيوم/الدهون في غذاء الإنسان هي 0.04-0.08 جرام كالسيوم لكل 1 جرام من الدهون. يحدث إفراز الكالسيوم بشكل رئيسي من خلال الأمعاء. تفقد الثدييات الكثير من الكالسيوم في الحليب أثناء الرضاعة. مع الاضطرابات في استقلاب الفوسفور والكالسيوم، يتطور الكساح عند الحيوانات الصغيرة والأطفال، وتتطور التغيرات في تكوين وبنية الهيكل العظمي (لين العظام) في الحيوانات البالغة.
عُرفت مركبات الكالسيوم منذ العصور القديمة، ولكن ليس حتى القرن السابع عشر. لم يعرفوا شيئًا عن طبيعتهم. اعتمدت الملاط المصري المستخدم في أهرامات الجيزة على الجبس المجفف جزئيًا، CaSO 4 · 2H 2 O. وهذا أيضًا أساس كل الجص الموجود في مقبرة توت عنخ آمون. استخدم الرومان ملاطًا من الرمل والجير (مصنوع عن طريق تسخين الحجر الجيري باستخدام CaCO 3): وكان أكثر استقرارًا في المناخ الرطب في إيطاليا.
يأتي اسم العنصر من الكلس اللاتيني، calcis - الجير ("الحجر الناعم"). تم اقتراحه من قبل جي ديفي في عام 1808، الذي عزل معدن الكالسيوم بطريقة التحليل الكهربائي. قام ديفي بخلط "تراب" الكالسيوم الرطب (أكسيد الكالسيوم CaO) مع أكسيد الزئبق HgO على لوح من البلاتين، والذي كان بمثابة الأنود. كان الكاثود عبارة عن سلك بلاتيني مغمور في الزئبق السائل. نتيجة للتحليل الكهربائي، تم الحصول على ملغم من المعدن، والذي يمكن الحصول عليه في شكله النقي عن طريق تبخير الزئبق.
الكالسيوم هو العنصر الخامس الأكثر وفرة في القشرة الأرضية وثالث أكثر المعادن وفرة (بعد الألومنيوم والحديد). ويشكل الكالسيوم حوالي 1.5% منه الرقم الإجماليذرات القشرة الأرضية. تحتوي أجزاء كثيرة من سطح الأرض على رواسب رسوبية كبيرة من كربونات الكالسيوم، والتي تكونت من بقايا الكائنات البحرية القديمة. يوجد هذا المركب فيها بشكل رئيسي على شكل نوعين من المعادن. الكالسيت المعيني السطوح هو الأكثر شيوعًا، ويتشكل الأراغونيت ذو الشكل المستقيمي في البحار الدافئة. ممثلو النوع الأول من المعادن هم الكالسيت نفسه، وكذلك الدولوميت والرخام والطباشير والصاري الأيسلندي. طبقات ضخمة من كربونات الكالسيوم على شكل أراغونيت تشكل جزر البهاما وفلوريدا كيز وحوض البحر الأحمر. المعادن الهامة الأخرى هي الجبس CaSO 4 · 2H 2 O، الأنهيدريت CaSO 4، الفلوريت CaF 2 والأباتيت Ca 5 (PO 4) 3 (Cl، OH، F). توجد كمية كبيرة من الكالسيوم في المياه الطبيعيةعلى شكل بيكربونات ( سم. كيمياء الغلاف المائي). ويوجد الكالسيوم أيضًا في أجسام العديد من الحيوانات. هيدروكسواباتيت Ca 5 (PO 4) 3 (OH) هو أساس الأنسجة العظمية للفقاريات. توجد كربونات الكالسيوم بشكل رئيسي في المرجان، وقذائف الرخويات، واللؤلؤ، وقشر البيض.
يتم إنتاج معدن الكالسيوم عن طريق التحليل الكهربائي لكلوريد الكالسيوم المنصهر، وهو منتج ثانوي لعملية سولفاي أو يتشكل في تفاعل بين حامض الهيدروكلوريكوكربونات الكالسيوم.
المعدن الناعم اللامع نسبيًا له لون أصفر شاحب. وهو أقل نشاطا كيميائيا من المعادن الأرضية القلوية الأخرى، لأنه في الهواء مغطى بطبقة واقية من أكسيد نتريد. ويمكن حتى معالجتها على مخرطة.
يتفاعل الكالسيوم بشكل نشط مع المواد غير المعدنية. عند تسخينه في الأكسجين والهواء، فإنه يشتعل. يتفاعل الكالسيوم مع الماء لتحرير الهيدروجين وتكوين هيدروكسيد الكالسيوم. وهو يذوب في الأمونيا السائلة لتكوين محاليل زرقاء داكنة، يمكن الحصول منها عند تبخرها على أمونيا نحاسية لامعة Ca(NH3)6.
يستخدم معدن الكالسيوم بشكل رئيسي كمادة مضافة لصناعة السبائك. وبالتالي فإن إدخال الكالسيوم يزيد من قوة محامل الألومنيوم. يستخدم الكالسيوم لتنظيم محتوى الكربون في الحديد الزهر وإزالة البزموت من الرصاص. يتم استخدامه لتنظيف الفولاذ من الأكسجين والكبريت والفوسفور. كما أنها تستخدم لامتصاص الأكسجين والنيتروجين، على وجه الخصوص، لإزالة شوائب النيتروجين من الأرجون التقني. وهو بمثابة عامل اختزال في إنتاج المعادن الأخرى مثل الكروم والزركونيوم والثوريوم واليورانيوم. على سبيل المثال، يمكن الحصول على معدن الزركونيوم من ثاني أكسيده: ZrO 2 + 2Ca = Zr + 2CaO. يتفاعل الكالسيوم أيضًا بشكل مباشر مع الهيدروجين لتكوين هيدريد الكالسيوم CaH2، وهو مصدر مناسب للهيدروجين.
أهم هاليد الكالسيوم هو فلوريد CaF 2، لأنه في شكله المعدني (الفلوريت) هو المصدر الوحيد المهم صناعيا للفلور. فلوريد الكالسيوم الأبيض، المقاوم للحرارة، قابل للذوبان بشكل طفيف في الماء، والذي يستخدم في التحليل الكمي.
كلوريد الكالسيوم CaCl 2 له أيضًا أهمية كبيرة. وهو أحد مكونات المحاليل الملحية لوحدات التبريد ولملء إطارات الجرارات والمركبات الأخرى. يستخدم كلوريد الكالسيوم لإزالة الثلج والجليد من الطرق والأرصفة. خليط سهل الانصهار CaCl 2 –H 2 O يحتوي على 30 واط. % CaCl 2، يذوب عند -55 درجة مئوية. درجة الحرارة هذه أقل بكثير مما هي عليه في حالة خليط كلوريد الصوديوم مع الماء، حيث تكون نقطة الانصهار الدنيا هي -18 درجة مئوية. كما يستخدم كلوريد الكالسيوم لحماية الفحم و خام من التجميد أثناء النقل والتخزين. يتم استخدامه في الخلطات الخرسانية لتسريع بداية التجمد وزيادة القوة الأولية والنهائية للخرسانة. كلوريد الكالسيوم هو منتج نفايات للعديد من العمليات التكنولوجية الكيميائية، على وجه الخصوص، إنتاج الصودا على نطاق واسع. ومع ذلك، فإن استهلاك كلوريد الكالسيوم أقل بكثير من إنتاجه، لذلك تشكلت بحيرات كاملة مملوءة بمحلول ملحي CaCl 2 بالقرب من مصانع الصودا. يمكن رؤية أحواض التخزين هذه، على سبيل المثال، في دونباس.
مركبات الكالسيوم الأكثر استخدامًا هي الكربونات والأكسيد والهيدروكسيد. الشكل الأكثر شيوعا لكربونات الكالسيوم هو الحجر الجيري. يسمى خليط كربونات الكالسيوم والمغنيسيوم بالدولوميت. يستخدم الحجر الجيري والدولوميت كمواد بناء وأسطح الطرق وكواشف تقلل من حموضة التربة. يتم استخراجها في جميع أنحاء العالم بكميات ضخمة. كربونات الكالسيوم CaCO 3 هي أيضًا الكاشف الصناعي الأكثر أهمية، وهو ضروري لإنتاج أكسيد الكالسيوم (الجير الحي) CaO وهيدروكسيد الكالسيوم (الجير المطفأ) Ca(OH) 2.
يعد أكسيد الكالسيوم وهيدروكسيد من المواد الأساسية في العديد من مجالات الصناعات الهندسية الكيميائية والمعدنية والميكانيكية. يتم إنتاج Lime CaO بكميات ضخمة في العديد من البلدان وهو أحد البلدان العشرة الأوائل المواد الكيميائيةمع الحد الأقصى لحجم الإنتاج.
يتم استهلاك كميات كبيرة من الجير في إنتاج الصلب، حيث يتم استخدامه لإزالة الفوسفور والكبريت والسيليكون والمنغنيز. في عملية تحويل الأكسجين، يلزم 75 كجم من الجير لكل طن من الفولاذ. إنه يطيل عمر الكسوة المقاومة للحريق بشكل كبير. يستخدم الجير أيضًا كمواد تشحيم في سحب الأسلاك الفولاذية وتحييد سوائل تخليل النفايات التي تحتوي عليها حمض الكبريتيك. تطبيق آخر في علم المعادن هو إنتاج المغنيسيوم.
الجير هو المادة الكيميائية الأكثر شيوعا المستخدمة لمعالجة مصادر المياه لأغراض الشرب والأغراض الصناعية. يتم استخدامه مع الشب أو أملاح الحديد لتخثير المعلقات وإزالة العكارة، وكذلك لتليين المياه عن طريق إزالة عسر (البيكربونات) المؤقتة ( سم. تنقية المياه)
مجال آخر لتطبيق الجير هو تحييد المحاليل الحمضية والنفايات الصناعية. وبمساعدتها، يتم تحديد قيمة الرقم الهيدروجيني الأمثل للأكسدة الكيميائية الحيوية لمياه الصرف الصحي. ويستخدم الجير أيضًا في أجهزة تنقية الغاز لإزالة ثاني أكسيد الكبريت وكبريتيد الهيدروجين من غازات النفايات الناتجة عن محطات توليد الطاقة بالوقود الأحفوري وأفران صهر المعادن.
في الصناعة الكيميائية، يستخدم الجير في إنتاج كربيد الكالسيوم (للإنتاج اللاحق للأسيتيلين)، وسياناميد الكالسيوم والعديد من المواد الأخرى. صناعة الزجاج هي أيضا مستهلك مهم. تحتوي النظارات الأكثر شيوعًا على حوالي 12٪ من أكسيد الكالسيوم. يستخدم المبيد الحشري زرنيخات الكالسيوم، الذي يتم الحصول عليه عن طريق تحييد حمض الزرنيخ مع الجير، على نطاق واسع لمكافحة سوسة القطن، وعثة الترميز، ودودة التبغ، وخنفساء البطاطس في كولورادو. مبيدات الفطريات الهامة هي بخاخات كبريتات الجير و خلطات بوردووالتي يتم الحصول عليها من كبريتات النحاس وهيدروكسيد الكالسيوم.
هناك حاجة إلى كميات كبيرة من هيدروكسيد الكالسيوم لصناعة اللب والورق. في مصانع الورق، تتم معالجة مخلفات محلول كربونات الصوديوم بالجير لتجديد الصودا الكاوية (هيدروكسيد الصوديوم NaOH) المستخدمة في صناعة الورق. العملية التكنولوجية. يتم تجفيف حوالي 95% من ملاط كربونات الكالسيوم الناتج وإعادة حرقه في أفران دوارة لتجديد أكسيد الكالسيوم. يتم تحضير سوائل تبييض عجينة الورق المحتوية على هيبوكلوريت الكالسيوم عن طريق تفاعل الجير مع الكلور.
يتطلب إنتاج الورق عالي الجودة استخدام كربونات الكالسيوم المترسبة خصيصًا. للقيام بذلك، يتم أولاً حرق الحجر الجيري ويتم جمع ثاني أكسيد الكربون وأكسيد الكالسيوم بشكل منفصل. ثم تتم معالجة الأخير بالماء وتحويله مرة أخرى إلى كربونات. ويعتمد نوع البلورات المتكونة وكذلك حجمها وشكلها على درجة الحرارة ودرجة الحموضة وسرعة الخلط والتركيزات ووجود المواد المضافة. غالبًا ما تكون البلورات الصغيرة (أقل من 45 ميكرون) مغلفة بالأحماض الدهنية أو الراتنجات أو عوامل الترطيب. تمنح كربونات الكالسيوم الورق سطوعه وتعتيمه وقابليته لتقبل الحبر ونعومته. في المزيد تركيزات عاليةإنه يحيد اللمعان العالي الناتج عن إضافات الكاولين ويعطي لمسة نهائية باهتة. قد يحتوي هذا الورق على 5-50% (بالوزن) من كربونات الكالسيوم المترسبة. يُستخدم كربونات الكالسيوم 3 أيضًا كمادة حشو في المطاط، واللاتكس، والدهانات، والمينا، وكذلك في البلاستيك (حوالي 10% بالوزن) لتحسين مقاومتها للحرارة، وصلابتها، وصلابتها وقابليتها للتشغيل.
في الحياة اليومية والطب، يتم استخدام كربونات الكالسيوم المترسبة كعامل معادل للأحماض، كمادة كاشطة خفيفة في معاجين الأسنان، ومصدر للكالسيوم الإضافي في الوجبات الغذائية، عنصرالعلكة والحشو في مستحضرات التجميل.
ويستخدم الجير أيضا في صناعة الألبان. غالبًا ما يتم إضافة ماء الليمون (محلول مشبع من هيدروكسيد الكالسيوم) إلى الكريمة عند فصلها عن الحليب كامل الدسم لتقليل حموضته قبل البسترة وتحويله إلى زبدة. يتم بعد ذلك تحميض الحليب الخالي من الدسم لفصل الكازين، والذي يتم خلطه مع الجير لصنع غراء الكازين. بعد تخمير الحليب الخالي من الدسم المتبقي (مصل اللبن)، يضاف الجير لتحرير لاكتات الكالسيوم، والذي يستخدم في الطب أو كمواد خام لإنتاج حمض اللاكتيك لاحقًا. يتضمن إنتاج السكر أيضًا استخدام الجير. لترسيب سكروز الكالسيوم، والذي يتم تنقيته بعد ذلك من الفوسفات و التلوث العضوييتفاعل شراب السكر الخام مع الجير. يؤدي الإجراء اللاحق لثاني أكسيد الكربون إلى تكوين كربونات الكالسيوم غير القابلة للذوبان والسكروز المنقى القابل للذوبان. تتكرر الدورة عدة مرات. يتطلب سكر القصب عادة حوالي 3-5 كجم من الجير لكل طن، ويتطلب سكر البنجر مائة مرة أكثر، أي حوالي نصف طن من الجير لكل طن من السكر.
يمكن للمرء أيضًا ملاحظة مجال معين لتطبيق كربونات الكالسيوم على شكل عرق اللؤلؤ. وهي مادة تتكون من طبقات رقيقة من كربونات الكالسيوم على شكل أراغونيت، متماسكة معًا بواسطة غراء بروتيني. بعد التلميع يلمع بكل ألوان قوس قزح ويصبح مزخرفًا ومتينًا للغاية على الرغم من أن 95٪ يتكون من كربونات الكالسيوم.
توجد كبريتات الكالسيوم عادة في صورة ثنائي هيدرات (الجبس)، على الرغم من أنه يتم استخراج كبريتات الكالسيوم اللامائية (الأنهيدريت) أيضًا. المرمر معروف أيضًا - وهو شكل مضغوط وضخم ودقيق الحبيبات من CaSO 4 · 2H 2 O، يذكرنا بالرخام. إذا تم تحميص الجبس عند درجة حرارة 150-165 درجة مئوية، فإنه يفقد حوالي ثلثي ماء التبلور ويشكل نصف هيدرات CaSO 4 0.5H 2 O، المعروف أيضًا باسم بناء المرمر، أو "جص باريس" (حيث تم الحصول عليه في الأصل من الجبس المستخرج في مونمارتر). التدفئة في أكثر من ذلك درجة حرارة عاليةيؤدي إلى تكوين أشكال مختلفة لا مائي.
على الرغم من أن الجبس لا يتم استخراجه بنفس كميات الحجر الجيري، إلا أنه يظل مادة ذات أهمية صناعية. يتم استخدام كل الجبس المكلس تقريبًا (95٪) لإنتاج المنتجات شبه المصنعة - بشكل أساسي لوحات الحائط، والمبلغ المتبقي في الجص الصناعي والإنشائي. من خلال امتصاص الماء، يتوسع نصف الهيدرات قليلاً (بنسبة 0.2-0.3٪)، وهذا هو الشيء الرئيسي عند استخدامه للجص والجص. باستخدام المواد المضافة، يمكنك تغيير درجة توسعها في حدود 0.03-1.2٪.
لا يتميز الكالسيوم بتكوين مركبات معقدة. تعتبر المجمعات المحتوية على الأكسجين، على سبيل المثال مع EDTA أو متعدد الفوسفات، ذات أهمية كبيرة في الكيمياء التحليلية ولإزالة أيونات الكالسيوم من الماء العسر.
الكالسيوم هو أحد العناصر الكبيرة. محتواه في جسم شخص بالغ (على أساس وزن 65 كجم) هو 1.3 كجم. وهو ضروري لتكوين العظام والأسنان والحفاظ على إيقاع القلب وتخثر الدم. المصدر الرئيسي للكالسيوم في الجسم هو الحليب ومنتجات الألبان. الاحتياجات اليومية هي 0.8 جرام في اليوم. يتم تعزيز امتصاص كاتيونات الكالسيوم عن طريق الحليب و حمض الستريكبينما تعيق أيونات الفوسفات وأيون الأكسالات وحمض الفيتيك امتصاص الكالسيوم بسبب تكوين معقدات وأملاح ضعيفة الذوبان. الجسم لديه نظام معقدتخزين وإطلاق الكالسيوم.
يرجع استخدام الكالسيوم كمادة بناء للعظام والأسنان إلى عدم استخدام أيونات الكالسيوم في الخلية. يتم التحكم في تركيز الكالسيوم بواسطة هرمونات خاصة، حيث يحافظ عملها المشترك على بنية العظام ويحافظ عليها.
من المفترض أن أيونات الكالسيوم، من خلال ارتباطها بغشاء العصب، تؤثر على نفاذيته للكاتيونات الأخرى. ويبدو أنه يحل محل أيونات المغنيسيوم وبالتالي ينشط بعض الإنزيمات. يمكن أن يرتبط إمداد أيونات الكالسيوم بإدخال الفوسفات، والذي يسمى بالتالي ناقل الكالسيوم.
لقد ثبت أن منظم أيونات الكالسيوم في أنواع مختلفةالعضلات هي الشبكة الساركوبلازمية (SR). تتراكم أيونات الكالسيوم في البروتينات المرتبطة بالكالسيوم، مثل كالسيكسترين. يرتبط الأخير بحوالي 43 أيون Ca 2+ لكل مول من البروتين. يرتبط تقلص العضلات بإطلاق أيونات الكالسيوم من SR وارتباطها بالمراكز النشطة للألياف العضلية. يزداد تركيز أيونات الكالسيوم في الساركوبلازم 100 مرة في بضعة أجزاء من الثانية. يحدث التدفق القسري لأيونات Ca 2+ من SR بسرعة كبيرة. مباشرة بعد إطلاق أيونات الكالسيوم، يبدأ SR في ضخها مرة أخرى. يحدث انقباض العضلات نتيجة ظهور سيالة عصبية في العصب الحركي المنتهي في الليفة العضلية، مما يتسبب في إطلاق أيونات الكالسيوم من مخازنها.
آلية تخثر الدم هي عملية متتالية، تعتمد العديد من خطواتها على وجود أيونات الكالسيوم، التي تنشط الإنزيمات المقابلة.
تراكم الكالسيوم هو ميزة مميزةنمو عظام الأسنان والأصداف وغيرها من الهياكل المماثلة. من ناحية أخرى، تؤدي زيادة مستويات الكالسيوم في المناطق غير النمطية إلى تكوين الحصوات والتهاب المفاصل العظمي وإعتام عدسة العين واضطرابات الشرايين.
ايلينا سافينكينا