يبني ثابت بولتزمان جسرًا من العالم الكبير إلى العالم المصغر، ويربط درجة الحرارة بالطاقة الحركية للجزيئات.
يعد لودفيج بولتزمان أحد واضعي النظرية الحركية الجزيئية للغازات، والتي اعتمدت عليها الصورة الحديثة للعلاقة بين حركة الذرات والجزيئات، من ناحية، والخصائص العيانية للمادة، مثل درجة الحرارة والضغط، والآخر، على أساس. في هذه الصورة، يتم تحديد ضغط الغاز من خلال التأثيرات المرنة لجزيئات الغاز على جدران الوعاء، ويتم تحديد درجة الحرارة من خلال سرعة حركة الجزيئات (أو بالأحرى طاقتها الحركية)، وكلما زادت سرعة حركة الجزيئات، كلما زادت سرعة حركة الجزيئات. ارتفاع درجة الحرارة.
يجعل ثابت بولتزمان من الممكن ربط خصائص العالم الصغير بشكل مباشر بخصائص العالم الكبير - على وجه الخصوص، مع قراءات مقياس الحرارة. فيما يلي الصيغة الأساسية التي تؤسس هذه العلاقة:
1/2 إم في 2 = كيلو طن
أين مو الخامس-على التوالي الكتلة و متوسط السرعةحركة جزيئات الغاز, تهي درجة حرارة الغاز (على مقياس كلفن المطلق)، و ك -ثابت بولتزمان. هذه المعادلة تسد الفجوة بين العالمين، وتربط خصائص المستوى الذري (على الجانب الأيسر) مع الخصائص الحجمية(على الجانب الأيمن)، والتي يمكن قياسها باستخدام الأدوات البشرية، في في هذه الحالةموازين الحرارة. يتم توفير هذا الاتصال بواسطة ثابت بولتزمان ك، يساوي 1.38 × 10 -23 جول/ك.
يسمى فرع الفيزياء الذي يدرس الروابط بين ظواهر العالم الصغير والعالم الكبير الميكانيكا الإحصائية.لا تكاد توجد معادلة أو صيغة في هذا القسم لا تتضمن ثابت بولتزمان. إحدى هذه العلاقات اشتقها النمساوي نفسه، وهي تسمى ببساطة معادلة بولتزمان:
س = كسجل ص + ب
أين س-إنتروبيا النظام ( سم.القانون الثاني للديناميكا الحرارية) ص- ما يسمى الوزن الإحصائي(عنصر مهم جدا في النهج الإحصائي)، و ب- ثابت آخر.
طوال حياته، كان لودفيج بولتزمان متقدمًا على عصره حرفيًا، حيث طور أسس النظرية الذرية الحديثة لبنية المادة، ودخل في نزاعات شرسة مع الأغلبية المحافظة الساحقة من المجتمع العلمي في عصره، الذين اعتبروا الذرات مجرد اتفاقية ، مناسب لإجراء العمليات الحسابية، ولكن ليس كائنات من العالم الحقيقي. عندما لم يلق منهجه الإحصائي أدنى فهم حتى بعد ظهور النظرية النسبية الخاصة، انتحر بولتزمان في لحظة اكتئاب عميق. معادلة بولتزمان محفورة على شاهد قبره.
بولتزمان، 1844-1906
عالم فيزياء نمساوي. ولد في فيينا لعائلة موظف حكومي. درس في جامعة فيينا في نفس الدورة مع جوزيف ستيفان ( سم.قانون ستيفان بولتزمان). وبعد أن دافع عن نفسه في عام 1866، واصل مسيرته العلمية، وشغل مناصب فيها وقت مختلفأستاذ في أقسام الفيزياء والرياضيات في جامعات غراتس وفيينا وميونيخ ولايبزيغ. كونه أحد المؤيدين الرئيسيين لحقيقة وجود الذرات، فقد قام بعدد من الاكتشافات النظرية المتميزة التي ألقت الضوء على كيفية تأثير الظواهر على المستوى الذري الخصائص الفيزيائيةوسلوك المادة.
المعنى المادي: ثابت الغاز i يساوي عدديًا عمل تمدد مول واحد من الغاز المثالي في عملية متساوية الضغط مع زيادة في درجة الحرارة بمقدار 1 كلفن
في نظام GHS، ثابت الغاز يساوي:
ثابت الغاز النوعي يساوي:
في الصيغة التي استخدمناها:
ثابت الغاز العالمي (ثابت مندلييف)
ثابت بولتزمان
رقم أفوجادرو
قانون أفوجادرو - الحجوم المتساوية من الغازات المختلفة عند درجة حرارة وضغط ثابتين تحتوي على نفس العدد من الجزيئات.
هناك نتيجتان طبيعيتان مشتقتان من قانون أفوجادرو:
النتيجة الطبيعية 1: المول الواحد من أي غاز تحت نفس الظروف يشغل نفس الحجم
على وجه الخصوص، في ظل الظروف العادية (T = 0 درجة مئوية (273K) وp = 101.3 كيلو باسكال)، يكون حجم مول واحد من الغاز 22.4 لترًا. يسمى هذا المجلد الحجم الموليغاز Vm. يمكن إعادة حساب هذه القيمة لدرجات الحرارة والضغوط الأخرى باستخدام معادلة مندليف-كلابيرون
1) قانون تشارلز:
2) قانون جاي لوساك:
3) قانون بوهل ماريوت:
النتيجة الطبيعية 2: النسبة بين كتلتي الحجومين المتساويتين لغازين هي قيمة ثابتة لهذين الغازين
هذا ثابتتسمى الكثافة النسبية للغازات ويشار إليها بـ D. نظرًا لأن الأحجام المولية لجميع الغازات هي نفسها (النتيجة الأولى لقانون أفوجادرو)، فإن نسبة الكتل المولية لأي زوج من الغازات تساوي أيضًا هذا الثابت:
في الصيغة استخدمنا:
كثافة الغاز النسبية
ضغط
الحجم المولي
ثابت الغاز العالمي
درجة الحرارة المطلقة
قانون بويل ماريوت - عند ثبات درجة الحرارة وكتلة الغاز المثالي، يكون حاصل ضرب ضغطه وحجمه ثابتًا.
وهذا يعني أنه كلما زاد الضغط على الغاز، انخفض حجمه، والعكس صحيح. بالنسبة لكمية ثابتة من الغاز، يمكن أيضًا تفسير قانون بويل-ماريوت بالطريقة الآتية: عند درجة حرارة ثابتة، يكون حاصل ضرب الضغط والحجم قيمة ثابتة. قانون بويل-ماريوت صحيح تمامًا بالنسبة للغاز المثالي وهو نتيجة لمعادلة مندليف-كلابيرون. بالنسبة للغازات الحقيقية، يتم تطبيق قانون بويل ماريوت تقريبًا. جميع الغازات تقريبًا تتصرف كغازات مثالية ولكن ليس أيضًا الضغوط العاليةوليس كثيرا درجات الحرارة المنخفضة.
لتسهيل الفهم قانون بويل ماريوتلنتخيل أنك تضغط على بالون منتفخ. بسبب ال مساحة فارغةيوجد ما يكفي من الهواء بين الجزيئات، وبدون صعوبة كبيرة، من خلال تطبيق بعض القوة والقيام ببعض العمل، سوف تضغط الكرة، مما يقلل من حجم الغاز بداخلها. هذا هو أحد الاختلافات الرئيسية بين الغاز والسائل. ففي حبة من الماء السائل، على سبيل المثال، تتجمع الجزيئات معًا بإحكام، كما لو كانت الحبة مملوءة بكريات مجهرية. لذلك، على عكس الهواء، فإن الماء لا يصلح للضغط المرن.
يوجد ايضا:
قانون تشارلز:
قانون جاي لوساك:
استخدمنا في القانون:
الضغط في وعاء واحد
حجم 1 سفينة
الضغط في الوعاء 2
السفن المجلد 2
قانون جاي لوساك - عند ضغط ثابت، يتناسب حجم كتلة ثابتة من الغاز مع درجة الحرارة المطلقة
الحجم V لكتلة معينة من الغاز عند ضغط غاز ثابت يتناسب طرديًا مع التغير في درجة الحرارة
قانون جاي لوساك صالح فقط للغازات المثالية، والغازات الحقيقية تخضع له عند درجات حرارة وضغوط بعيدة عن القيم الحرجة. إنها حالة خاصة من معادلة كلايبيرون.
يوجد ايضا:
معادلة مندلييف كلابيرون:
قانون تشارلز:
قانون بويل ماريوت:
استخدمنا في القانون:
الحجم في وعاء واحد
درجة الحرارة في وعاء واحد
الحجم في وعاء واحد
درجة الحرارة في وعاء واحد
حجم الغاز الأولي
حجم الغاز عند درجة الحرارة T
معامل التمدد الحراري للغازات
الفرق بين درجات الحرارة الأولية والنهائية
قانون هنري هو قانون ينص على أن ذوبان الغاز في سائل معين عند درجة حرارة ثابتة يتناسب طرديًا مع ضغط هذا الغاز فوق المحلول. القانون مناسب فقط للحلول المثالية والضغوط المنخفضة.
يصف قانون هنري عملية إذابة الغاز في السائل. نحن نعرف ما هو السائل الذي يذوب فيه الغاز من مثال المشروبات الغازية - غير الكحولية، والكحول المنخفض، وفي الأعياد الكبرى - الشمبانيا. تحتوي جميع هذه المشروبات على ثاني أكسيد الكربون المذاب (الصيغة الكيميائية CO2)، وهو غاز غير ضار يستخدم في صناعة المواد الغذائية بسبب ذوبانه الجيد في الماء، وجميع هذه المشروبات تزبد بعد فتح الزجاجة أو العلبة لأن الغاز المذاب يبدأ بالخروج من السائل إلى الغلاف الجوي، لأنه بعد فتح حاوية مغلقة ينخفض الضغط داخلها.
في الواقع، ينص قانون هنري على حقيقة بسيطة إلى حد ما: كلما زاد ضغط الغاز فوق سطح السائل، زادت صعوبة إطلاق الغاز المذاب فيه. وهذا أمر منطقي تمامًا من وجهة نظر النظرية الحركية الجزيئية، حيث أن جزيء الغاز، لكي يتحرر من سطح السائل، يحتاج إلى التغلب على طاقة الاصطدام بجزيئات الغاز فوق السطح، وكلما ارتفعت الضغط، ونتيجة لذلك، عدد الجزيئات في المنطقة الحدودية، كلما زادت صعوبة التغلب على هذا الحاجز للجزيء المذاب.
في الصيغة التي استخدمناها:
تركيز الغاز في المحلول بأجزاء المول
معامل هنري
الضغط الجزئي للغاز فوق المحلول
قانون كيرشوف للإشعاع – نسبة قدرات الانبعاث والامتصاص لا تعتمد على طبيعة الجسم، فهي واحدة لجميع الأجسام.
بحكم التعريف، يمتص الجسم الأسود تمامًا كل الإشعاعات الساقطة عليه، أي بالنسبة له (امتصاصية الجسم). لذلك تتزامن الوظيفة مع الابتعاثية
في الصيغة التي استخدمناها:
انبعاثية الجسم
قدرة الجسم على الامتصاص
وظيفة كيرشوف
قانون ستيفان بولتزمان - يتناسب اللمعان النشط لجسم أسود مع القوة الرابعة لدرجة الحرارة المطلقة.
يتضح من الصيغة أنه مع زيادة درجة الحرارة، لا يزداد لمعان الجسم فحسب، بل يزداد بدرجة أكبر بكثير. مضاعفة درجة الحرارة ويزداد اللمعان 16 مرة!
الأجسام الساخنة تنبعث منها الطاقة في الشكل موجات كهرومغناطيسيةأطوال مختلفة. عندما نقول أن الجسم "ساخن أحمر"، فهذا يعني أن درجة حرارته مرتفعة بما يكفي لحدوث الإشعاع الحراري في الجزء المرئي والمضيء من الطيف. على المستوى الذري، ينتج الإشعاع عن انبعاث الفوتونات من الذرات المثارة.
لفهم كيفية عمل هذا القانون، تخيل ذرة تبعث الضوء في أعماق الشمس. تمتص ذرة أخرى الضوء على الفور، ثم تنبعث منه مرة أخرى - وبالتالي ينتقل عبر سلسلة من ذرة إلى ذرة، مما يجعل النظام بأكمله في حالة توازن الطاقة. في حالة التوازن، يتم امتصاص ضوء ذو تردد محدد بدقة بواسطة ذرة واحدة في مكان واحد في وقت واحد مع انبعاث ضوء بنفس التردد من ذرة أخرى في مكان آخر. ونتيجة لذلك، تظل شدة الضوء لكل طول موجي من الطيف دون تغيير.
تنخفض درجة الحرارة داخل الشمس عندما تبتعد عن مركزها. لذلك، عندما تتحرك نحو السطح، يبدو أن طيف الإشعاع الضوئي يتوافق أكثر درجات حرارة عاليةمن درجة الحرارة بيئة. ونتيجة لذلك، عند إعادة الإشعاع، وفقا ل قانون ستيفان بولتزمانسيحدث عند طاقات وترددات أقل، ولكن في نفس الوقت، وبسبب قانون حفظ الطاقة، سينبعث عدد أكبر من الفوتونات. وبالتالي، بحلول الوقت الذي يصل فيه إلى السطح، سيتوافق التوزيع الطيفي مع درجة حرارة سطح الشمس (حوالي 5800 كلفن) وليس درجة الحرارة في مركز الشمس (حوالي 15000000 كلفن).
الطاقة التي تصل إلى سطح الشمس (أو سطح أي جسم ساخن) تتركها على شكل إشعاع. يخبرنا قانون ستيفان-بولتزمان بالضبط ما هي الطاقة المنبعثة.
في الصياغة أعلاه قانون ستيفان بولتزمانيمتد فقط إلى جسم أسود بالكامل، والذي يمتص كل الإشعاعات الساقطة على سطحه. تمتص الأجسام المادية الحقيقية جزءًا فقط من طاقة الإشعاع، وينعكس الجزء المتبقي منها، ومع ذلك، فإن النمط الذي بموجبه تتناسب قوة الإشعاع المحددة من سطحها مع T في 4، كقاعدة عامة، يظل كما هو في هذا ومع ذلك، في هذه الحالة، يجب استبدال ثابت بولتزمان بمعامل آخر يعكس خصائص الجسم المادي الحقيقي. وعادة ما يتم تحديد هذه الثوابت تجريبيا.
في الصيغة التي استخدمناها:
لمعان الطاقة في الجسم
ثابت ستيفان-بولتزمان
درجة الحرارة المطلقة
قانون تشارلز - ضغط كتلة معينة من الغاز المثالي عند حجم ثابت يتناسب طرديًا مع درجة الحرارة المطلقة
لتسهيل الفهم قانون تشارلزتخيل الهواء في الداخل بالون. عند درجة حرارة ثابتة، يتمدد الهواء الموجود في البالون أو ينكمش حتى يصل الضغط الناتج عن جزيئاته إلى 101325 باسكال ويساوي الضغط الجوي. بمعنى آخر، حتى مقابل كل ضربة لجزيء الهواء من الخارج، موجهة إلى الكرة، ستكون هناك ضربة مماثلة لجزيء الهواء، موجهة من داخل الكرة إلى الخارج.
إذا خفضت درجة حرارة الهواء في الكرة (على سبيل المثال، عن طريق وضعها في ثلاجة كبيرة)، فإن الجزيئات الموجودة داخل الكرة ستبدأ في التحرك بشكل أبطأ، وتضرب جدران الكرة بقوة أقل من الداخل. ستؤدي جزيئات الهواء الخارجي بعد ذلك إلى زيادة الضغط على الكرة، مما يؤدي إلى ضغطها، ونتيجة لذلك، سينخفض حجم الغاز داخل الكرة. سيحدث هذا حتى تعوض الزيادة في كثافة الغاز انخفاض درجة الحرارة، ثم سيتم إنشاء التوازن مرة أخرى.
يوجد ايضا:
معادلة مندلييف كلابيرون:
قانون جاي لوساك:
قانون بويل ماريوت:
استخدمنا في القانون:
الضغط في وعاء واحد
درجة الحرارة في وعاء واحد
الضغط في الوعاء 2
درجة الحرارة في الوعاء 2
القانون الأول للديناميكا الحرارية - التغير في الطاقة الداخلية ΔU غير معزول النظام الديناميكي الحرارييساوي الفرق بين كمية الحرارة Q المنقولة إلى النظام والشغل A للقوى الخارجية
بدلًا من العمل A الذي تؤديه قوى خارجية على نظام ديناميكي حراري، غالبًا ما يكون أكثر ملاءمة للنظر في العمل A’ الذي يؤديه النظام الديناميكي الحراري على الأجسام الخارجية. وبما أن هذه الأعمال متساوية في القيمة المطلقة، ولكنها متضادة في الإشارة:
ثم بعد هذا التحول القانون الأول للديناميكا الحراريةسوف تبدو مثل:
القانون الأول للديناميكا الحرارية - في النظام الديناميكي الحراري غير المعزول، يكون التغير في الطاقة الداخلية مساويًا للفرق بين كمية الحرارة Q المستلمة والشغل A' الذي يؤديه هذا النظام
تكلم بلغة بسيطة القانون الأول للديناميكا الحراريةيتحدث عن طاقة لا يمكن خلقها من تلقاء نفسها وتختفي في لا مكان، بل تنتقل من نظام إلى آخر وتتحول من شكل إلى آخر (ميكانيكي إلى حراري).
نتيجة مهمة القانون الأول للديناميكا الحراريةهو أنه من المستحيل إنشاء آلة (محرك) قادرة على ذلك عمل مفيددون استهلاك الطاقة الخارجية. هذه الآلة الافتراضية كانت تسمى آلة الحركة الدائمة من النوع الأول.
بولتزمان لودفيج (1844-1906)- عالم فيزياء نمساوي كبير، أحد مؤسسي نظرية الحركية الجزيئية. في أعمال بولتزمان، ظهرت النظرية الحركية الجزيئية لأول مرة كنظرية فيزيائية متماسكة منطقيا. أعطى بولتزمان تفسيرا إحصائيا للقانون الثاني للديناميكا الحرارية. لقد فعل الكثير لتطوير النظرية ونشرها حقل كهرومغناطيسيماكسويل. كان بولتزمان مناضلًا بطبيعته، وقد دافع بحماس عن الحاجة إلى تفسير جزيئي للظواهر الحرارية وتحمل وطأة النضال ضد العلماء الذين أنكروا وجود الجزيئات.
تتضمن المعادلة (4.5.3) نسبة ثابت الغاز العالمي ر لثابت أفوجادرو ن أ . وهذه النسبة هي نفسها بالنسبة لجميع المواد. ويسمى ثابت بولتزمان، تكريماً لـ ل. بولتزمان، أحد مؤسسي نظرية الحركة الجزيئية.
ثابت بولتزمان هو:
 (4.5.4)
(4.5.4)
المعادلة (4.5.3) مع الأخذ في الاعتبار ثابت بولتزمان تكتب كما يلي:
 (4.5.5)
(4.5.5)
المعنى الفيزيائي لثابت بولتزمان
تاريخيًا، تم تقديم درجة الحرارة لأول مرة ككمية ديناميكية حرارية، وتم تحديد وحدة قياسها - الدرجات (انظر الفقرة 3.2). بعد إثبات العلاقة بين درجة الحرارة ومتوسط الطاقة الحركية للجزيئات، أصبح من الواضح أنه يمكن تعريف درجة الحرارة بأنها متوسط الطاقة الحركية للجزيئات ويتم التعبير عنها بالجول أو الإرج، أي بدلاً من الكمية. تأدخل القيمة تي*لهذا السبب. 
ترتبط درجة الحرارة المحددة على هذا النحو بدرجة الحرارة المعبر عنها بالدرجات على النحو التالي:

ولذلك، يمكن اعتبار ثابت بولتزمان بمثابة الكمية التي تربط درجة الحرارة، معبرًا عنها بوحدات الطاقة، بدرجة الحرارة، معبرًا عنها بالدرجات.
اعتماد ضغط الغاز على تركيز جزيئاته ودرجة حرارته
وقد أعربت همن العلاقة (4.5.5) واستبدالها في الصيغة (4.4.10) نحصل على تعبير يوضح اعتماد ضغط الغاز على تركيز الجزيئات ودرجة الحرارة:
 (4.5.6)
(4.5.6)
ويترتب على الصيغة (4.5.6) أنه عند نفس الضغوط ودرجات الحرارة، يكون تركيز الجزيئات في جميع الغازات هو نفسه.
وهذا يعني قانون أفوجادرو: تحتوي الأحجام المتساوية من الغازات عند نفس درجات الحرارة والضغوط على نفس العدد من الجزيئات.
يتناسب متوسط الطاقة الحركية للحركة الانتقالية للجزيئات بشكل مباشر مع درجة الحرارة المطلقة. عامل التناسب- ثابت بولتزمانك = 10 -23 جول/ك - بحاجة إلى أن نتذكر.
§ 4.6. توزيع ماكسويل
وفي عدد كبير من الحالات، فإن معرفة القيم المتوسطة للكميات الفيزيائية وحدها لا تكفي. على سبيل المثال، معرفة متوسط طول الأشخاص لا يسمح لنا بالتخطيط لإنتاج الملابس بأحجام مختلفة. أنت بحاجة إلى معرفة العدد التقريبي للأشخاص الذين يقع طولهم في فترة زمنية معينة. وبالمثل، من المهم معرفة أعداد الجزيئات التي لها سرعات مختلفة عن القيمة المتوسطة. وكان ماكسويل أول من اكتشف كيفية تحديد هذه الأرقام.
احتمال وقوع حدث عشوائي
في الفقرة 4.1 ذكرنا بالفعل أنه لوصف سلوك مجموعة كبيرة من الجزيئات، قدم ج. ماكسويل مفهوم الاحتمال.
وكما تم التأكيد عليه مرارًا وتكرارًا، فمن المستحيل من حيث المبدأ تتبع التغير في سرعة (أو زخم) جزيء واحد خلال فترة زمنية كبيرة. ومن المستحيل أيضًا تحديد سرعات جميع جزيئات الغاز بدقة في وقت معين. من الظروف العيانية التي يوجد فيها الغاز (حجم معين ودرجة حرارة معينة)، لا تتبع بالضرورة قيم معينة للسرعات الجزيئية. يمكن اعتبار سرعة الجزيء متغيرًا عشوائيًا، والذي في ظل ظروف مجهرية معينة يمكن أن يأخذ قيمًا مختلفة، تمامًا كما هو الحال عند رمي حجر النرد، يمكنك الحصول على أي عدد من النقاط من 1 إلى 6 (عدد جوانب النرد هو ستة). من المستحيل التنبؤ بعدد النقاط التي ستظهر عند رمي النرد. لكن احتمال التدحرج، على سبيل المثال، خمس نقاط أمر قابل للتحديد.
ما هو احتمال وقوع حدث عشوائي؟ دعها تنتج جدا رقم ضخم نالاختبارات (ن - عدد رميات النرد). وفي الوقت نفسه، في ن" في الحالات، كانت هناك نتيجة إيجابية للاختبارات (أي إسقاط خمسة). عندها يكون احتمال وقوع حدث معين يساوي نسبة عدد الحالات ذات النتيجة الإيجابية إلى العدد الإجمالي للتجارب، بشرط أن يكون هذا العدد كبيرًا حسب الرغبة:
 (4.6.1)
(4.6.1)
بالنسبة للنرد المتماثل، فإن احتمال أي عدد مختار من النقاط من 1 إلى 6 هو .
نرى أنه على خلفية العديد من الأحداث العشوائية، يتم الكشف عن نمط كمي معين، ويظهر الرقم. هذا الرقم - الاحتمال - يسمح لك بحساب المتوسطات. لذا، إذا رميت 300 نرد، فإن متوسط عدد الخمسات، كما يلي من الصيغة (4.6.1)، سيكون مساويًا لـ: 300 = 50، ولا فرق على الإطلاق بين رمي نفس النرد 300 مرة أو 300 نفس النرد في نفس الوقت .
ليس هناك شك في أن سلوك جزيئات الغاز في الوعاء أكثر تعقيدًا من حركة حجر النرد. ولكن هنا أيضاً يستطيع المرء أن يأمل في اكتشاف أنماط كمية معينة تجعل من الممكن حساب المتوسطات الإحصائية، شريطة أن يتم طرح المشكلة بنفس الطريقة كما في نظرية الألعاب، وليس كما في الميكانيكا الكلاسيكية. من الضروري التخلي عن المشكلة غير القابلة للحل المتمثلة في تحديد القيمة الدقيقة للسرعة الجزيئية هذه اللحظةوحاول إيجاد احتمال أن تكون للسرعة قيمة معينة.
وفقًا لقانون ستيفان-بولتزمان، كثافة الإشعاع النصف كروي المتكامل ه 0يعتمد فقط على درجة الحرارة ويتغير بشكل متناسب مع القوة الرابعة لدرجة الحرارة المطلقة ت:
ثابت ستيفان-بولتزمان σ0 هو ثابت فيزيائي مدرج في القانون الذي يحدد الكثافة الحجمية للإشعاع الحراري المتوازن لجسم أسود تمامًا:
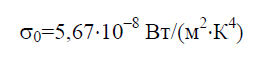
تاريخيًا، تمت صياغة قانون ستيفان-بولتزمان قبل قانون بلانك للإشعاع، والذي يتبعه نتيجة لذلك. يحدد قانون بلانك الاعتماد على كثافة التدفق الطيفي للإشعاع ه 0 على الطول الموجي α ودرجة الحرارة ت:

حيث LA – الطول الموجي، م؛ مع=2.998 10 8 م/ث – سرعة الضوء في الفراغ؛ ت- درجة حرارة الجسم، ك؛
ح= 6.625 ×10 -34 J×s – ثابت بلانك.
ثابت فيزيائي ك, يساوي النسبةثابت الغاز العالمي ر=8314J/(كجم×ك) إلى عدد أفوجادرو لا.=6.022× 10 26 1/(كجم×مول):

عدد تكوينات النظام المختلفة من نجزيئات لمجموعة معينة من الأرقام ن ط(عدد الجزيئات في أنا-الحالة التي تتوافق معها الطاقة e i) تتناسب مع القيمة:

ضخامة دبليوهناك عدد من طرق التوزيع نالجسيمات حسب مستويات الطاقة إذا كانت العلاقة (6) صحيحة، فإنه يعتبر أن النظام الأصلي يخضع لإحصائيات بولتزمان. مجموعة من الأرقام ن ط، حيث الرقم دبليوالحد الأقصى، يحدث بشكل متكرر ويتوافق مع التوزيع الأكثر احتمالاً.
الحركية الجسدية– النظرية المجهرية للعمليات في الأنظمة غير المتوازنة إحصائيا.
يمكن تنفيذ وصف عدد كبير من الجسيمات بنجاح باستخدام الطرق الاحتمالية. بالنسبة للغاز أحادي الذرة، يتم تحديد حالة مجموعة الجزيئات من خلال إحداثياتها وقيم إسقاطات السرعة على محاور الإحداثيات المقابلة. رياضيًا، يتم وصف ذلك بواسطة دالة التوزيع، التي تميز احتمالية وجود الجسيم في حالة معينة:

هو العدد المتوقع للجزيئات في الحجم d d الذي تقع إحداثياته في النطاق من إلى +d، وسرعاته في المدى من إلى +d.
إذا كان من الممكن إهمال متوسط الطاقة الكامنة لتفاعل الجزيئات مقارنة مع طاقتها الحركية، فإن الغاز يسمى الغاز المثالي. يُسمى الغاز المثالي بغاز بولتزمان إذا كانت نسبة طول مسار جزيئات هذا الغاز إلى الحجم المميز للتدفق لبالطبع، أي.

لأن طول المسار يتناسب عكسيا الثانية 2(ن هي الكثافة العددية 1/م3، د هو قطر الجزيء، م).
مقاس

مُسَمًّى ح- دالة بولتزمان لوحدة الحجم، والتي ترتبط باحتمال اكتشاف نظام من جزيئات الغاز في حالة معينة. تتوافق كل حالة مع أعداد معينة من خلايا السرعة الفضائية السداسية الأبعاد التي يمكن تقسيم مساحة الطور للجزيئات قيد النظر إليها. دعونا نشير دبليواحتمال وجود جزيئات N 1 في الخلية الأولى من المساحة قيد النظر، وجزيئات N 2 في الخلية الثانية، وما إلى ذلك.
حتى الثابت الذي يحدد أصل الاحتمال، تكون العلاقة التالية صحيحة:
 ,
,
أين  - وظيفة H لمنطقة من الفضاء أالمحتلة بالغاز. ومن (9) يتضح ذلك دبليوو حمترابطة، أي. يؤدي التغيير في احتمالية الحالة إلى تطور مماثل للدالة H.
- وظيفة H لمنطقة من الفضاء أالمحتلة بالغاز. ومن (9) يتضح ذلك دبليوو حمترابطة، أي. يؤدي التغيير في احتمالية الحالة إلى تطور مماثل للدالة H.

مبدأ بولتزمان يؤسس العلاقة بين الإنتروبيا س النظام الماديوالاحتمال الديناميكي الحراري دبليودولها:

(تم نشره وفقًا للمنشور: Kogan M.N. ديناميات الغاز المخلخل. - M.: Nauka، 1967.)
نظرة عامة على CUBE:

أين هي قوة الكتلة بسبب وجود مجالات مختلفة (الجاذبية والكهربائية والمغناطيسية) تعمل على الجزيء؛ ج- تكامل التصادم. هذا المصطلح من معادلة بولتزمان هو الذي يأخذ في الاعتبار تصادمات الجزيئات مع بعضها البعض والتغيرات المقابلة في سرعات الجسيمات المتفاعلة. تكامل التصادم هو تكامل خماسي الأبعاد وله البنية التالية:

تم الحصول على المعادلة (12) مع التكامل (13) لاصطدامات الجزيئات التي لا تنشأ فيها قوى عرضية، أي. تعتبر الجسيمات المتصادمة سلسة تمامًا.
أثناء التفاعل، لا تتغير الطاقة الداخلية للجزيئات، أي. من المفترض أن تكون هذه الجزيئات مرنة تمامًا. يتم النظر في مجموعتين من الجزيئات، لها سرعات وقبل الاصطدام مع بعضها البعض (تصادم)، وبعد الاصطدام، على التوالي، السرعات و. ويسمى الفرق في السرعة بالسرعة النسبية، أي. . ومن الواضح أن الاصطدام المرن السلس . وظائف التوزيع f 1 "، f"، f 1 ، fوصف جزيئات المجموعات المقابلة بعد الاصطدامات وقبلها، أي. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

أرز. 1. اصطدام جزيئين.
(13) يتضمن معلمتين تميزان موقع الجزيئات المتصادمة بالنسبة لبعضها البعض: بو ε؛ ب- مسافة الهدف، أي. أصغر مسافة يمكن أن تقترب منها الجزيئات في غياب التفاعل (الشكل 2)؛ ε تسمى معلمة الاصطدام الزاوي (الشكل 3). انتهى التكامل بمن 0 إلى ¥ ومن 0 إلى 2p (تكاملان خارجيان في (12)) يغطي كامل مستوى تفاعل القوة المتعامد مع المتجه

أرز. 2. مسار الجزيئات.

أرز. 3. النظر في تفاعل الجزيئات في نظام الإحداثيات الأسطواني: ض, ب, ε
يتم اشتقاق معادلة بولتزمان الحركية بموجب الافتراضات والافتراضات التالية.
1. يُعتقد أن الاصطدامات تحدث بشكل رئيسي بين جزيئين، أي. إن دور تصادم ثلاثة جزيئات أو أكثر في وقت واحد ليس له أهمية. هذا الافتراض يجعل من الممكن استخدام دالة توزيع الجسيم الواحد للتحليل، والتي كانت تسمى ببساطة دالة التوزيع أعلاه. مع الأخذ بعين الاعتبار تصادم ثلاثة جزيئات يؤدي إلى ضرورة استخدام دالة التوزيع بين الجسيمين في الدراسة. وبناء على ذلك، يصبح التحليل أكثر تعقيدا بكثير.
2. افتراض الفوضى الجزيئية. يتم التعبير عنه في حقيقة أن احتمالات اكتشاف الجسيم 1 عند نقطة الطور والجسيم 2 عند نقطة الطور مستقلة عن بعضها البعض.
3. إن تصادمات الجزيئات مع أي مسافة تصادم محتملة بنفس القدر، أي. لا تتغير وظيفة التوزيع عند قطر التفاعل. وتجدر الإشارة إلى أن العنصر الذي تم تحليله يجب أن يكون صغيراً بحيث Fداخل هذا العنصر لا يتغير، ولكن في نفس الوقت، بحيث يكون التقلب النسبي ~ ليس كبيرًا. إن إمكانات التفاعل المستخدمة في حساب تكامل التصادم تكون متناظرة كرويًا، أي. ![]() .
.
توزيع ماكسويل بولتزمان
يتم وصف حالة توازن الغاز من خلال توزيع ماكسويل المطلق، وهو الحل الدقيق لمعادلة بولتزمان الحركية:

حيث m هي كتلة الجزيء، كجم.
توزيع ماكسويل المحلي العام، والمعروف بتوزيع ماكسويل-بولتزمان:

في حالة تحرك الغاز ككل بسرعة والمتغيرات n، T تعتمد على الإحداثيات
والوقت ر.
في مجال الجاذبية الأرضية، يظهر الحل الدقيق لمعادلة بولتزمان:

أين ن 0 = الكثافة على سطح الأرض 1/م3؛ ز- تسارع الجاذبية، م/ث 2 ؛ ح- الارتفاع م الصيغة (16) هي الحل الدقيق لمعادلة بولتزمان الحركية سواء في الفضاء غير المحدود أو في وجود حدود لا تخالف هذا التوزيع، في حين يجب أن تظل درجة الحرارة ثابتة أيضا.
تم تصميم هذه الصفحة بواسطة Puzina Yu.Yu. بدعم من المؤسسة الروسية للبحوث الأساسية - المشروع رقم 08-08-00638.
ثابت بولتزمان (أو ) - ثابت فيزيائي يحدد العلاقة بين درجة الحرارة والطاقة. سُميت على اسم الفيزيائي النمساوي لودفيج بولتزمان، الذي قدم مساهمات كبيرة في الفيزياء الإحصائية، حيث يلعب هذا الثابت دورًا رئيسيًا. قيمته التجريبية في النظام الدولي للوحدات (SI) هي:
ي/.
تشير الأرقام الموجودة بين قوسين إلى الخطأ القياسي في الأرقام الأخيرة من القيمة. في نظام بلانك الطبيعي للوحدات، يتم إعطاء الوحدة الطبيعية لدرجة الحرارة بطريقة يكون فيها ثابت بولتزمان مساويًا لواحد.
العلاقة بين درجة الحرارة والطاقة
في غاز مثالي متجانس عند درجة الحرارة المطلقة ، الطاقة لكل درجة انتقالية من الحرية متساوية، على النحو التالي من توزيع ماكسويل، . في درجة حرارة الغرفة (300) هذه الطاقة J، أو 0.013 فولت. في الغاز المثالي أحادي الذرة، تتمتع كل ذرة بثلاث درجات من الحرية تقابل ثلاثة محاور مكانية، مما يعني أن كل ذرة لديها طاقة قدرها .
معرفة طاقة حراريةيمكننا حساب جذر متوسط مربع سرعة الذرات، والذي يتناسب عكسيا الجذر التربيعي الكتلة الذرية. يتراوح جذر متوسط مربع السرعة عند درجة حرارة الغرفة من 1370 م/ث للهيليوم إلى 240 م/ث للزينون. في حالة الغاز الجزيئي، يصبح الوضع أكثر تعقيدًا، على سبيل المثال، يتمتع الغاز ثنائي الذرة بخمس درجات من الحرية (عند درجات حرارة منخفضة، عندما لا تكون اهتزازات الذرات في الجزيء مثارة).
تعريف الانتروبيا
يتم تعريف إنتروبيا النظام الديناميكي الحراري على أنها اللوغاريتم الطبيعي لعدد الخلايا الدقيقة المختلفة ، المقابلة لحالة مجهرية معينة (على سبيل المثال، حالة ذات طاقة إجمالية معينة).
عامل التناسب وهو ثابت بولتزمان. هذا هو التعبير الذي يحدد العلاقة بين المجهرية ( ) والحالات العيانية ( )، يعبر عن الفكرة المركزية للميكانيكا الإحصائية.
تثبيت القيمة المفترضة
اعتمد المؤتمر العام الرابع والعشرون للأوزان والمقاييس، المنعقد في الفترة من 17 إلى 21 أكتوبر 2011، قرارًا يقترح، من بين أمور أخرى، مراجعة مستقبلية النظام الدولييتم إنتاج الوحدات بطريقة تثبت قيمة ثابت بولتزمان، وبعد ذلك سيتم اعتبارها محددة بالضبط. ونتيجة لذلك، سيتم تنفيذه بالضبطالمساواة ك\u003d 1.380 6X 10 −23 ي / ك. يرتبط هذا التثبيت المزعوم بالرغبة في إعادة تعريف وحدة درجة الحرارة الديناميكية الحرارية كلفن، وربط قيمتها بقيمة ثابت بولتزمان.
أنظر أيضا
اكتب مراجعة عن مقال "ثابت بولتزمان"
ملحوظات
| هذه مسودة مقالة عن الديناميكا الحرارية والفيزياء الإحصائية. يمكنك مساعدة المشروع عن طريق الإضافة إليه. |
مقتطف يميز ثابت بولتزمان
"لكن ماذا يعني هذا؟ - قالت ناتاشا مدروسًا.- أوه، أنا لا أعرف كم هو استثنائي كل هذا! - قالت سونيا وهي تمسك رأسها.
بعد بضع دقائق، اتصل الأمير أندريه، وجاءت ناتاشا لرؤيته؛ وسونيا، التي كانت تعاني من شعور بالإثارة والحنان نادرًا ما تشعر به، ظلت عند النافذة تفكر في كل ما حدث غير عادي.
في هذا اليوم، كانت هناك فرصة لإرسال رسائل إلى الجيش، وكتبت الكونتيسة رسالة إلى ابنها.
"سونيا"، قالت الكونتيسة وهي ترفع رأسها عن الرسالة بينما كانت ابنة أختها تمر بجانبها. - سونيا، ألن تكتبي إلى نيكولينكا؟ - قالت الكونتيسة بصوت هادئ مرتعش، وفي مظهر عينيها المتعبة، وهي تنظر من خلال النظارات، قرأت سونيا كل ما فهمته الكونتيسة في هذه الكلمات. وكانت هذه النظرة تعبر عن التوسل والخوف من الرفض والخجل من الاضطرار إلى السؤال والاستعداد للكراهية غير القابلة للتوفيق في حالة الرفض.
اقتربت سونيا من الكونتيسة وركعت وقبلت يدها.
قالت: "سأكتب يا أمي".
لقد خففت سونيا، متحمسة وتأثرت بكل ما حدث في ذلك اليوم، خاصة من خلال الأداء الغامض لقراءة الطالع الذي شاهدته للتو. الآن بعد أن عرفت أنه بمناسبة تجديد علاقة ناتاشا مع الأمير أندريه، لم يتمكن نيكولاي من الزواج من الأميرة ماريا، شعرت بسعادة بعودة مزاج التضحية بالنفس الذي أحببته واعتادت على العيش فيه. ومع الدموع في عينيها وبفرحة تحقيق عمل كريم، كتبت تلك الرسالة المؤثرة، التي أذهلت نيكولاي استلامها عدة مرات بالدموع التي غطت عينيها المخمليتين الأسودتين.
في غرفة الحراسة، حيث تم أخذ بيير، عامله الضابط والجنود الذين أخذوه بعدائية، ولكن في نفس الوقت باحترام. كان هناك أيضًا شعور بالشك في موقفهم تجاهه بشأن هويته (أليس كذلك؟ شخص مهم) والعداء بسبب صراعهم الشخصي الذي لا يزال جديدًا معه.
ولكن عندما جاءت المناوبة في صباح يوم آخر، شعر بيير أنه بالنسبة للحارس الجديد - للضباط والجنود - لم يعد له المعنى الذي كان له بالنسبة لأولئك الذين أخذوه. وبالفعل، في هذا الرجل الضخم السمين الذي يرتدي قفطان فلاح، لم يعد حراس اليوم التالي يرون ذلك الرجل الحي الذي قاتل بشدة مع اللص والجنود المرافقين وقال عبارة مهيبة عن إنقاذ الطفل، لكنهم رأوا فقط السابع عشر من المحتجزين لسبب ما بأمر من أعلى السلطات هم الروس المحتجزون. إذا كان هناك أي شيء مميز في بيير، فهو مظهره الخجول والمدروس باهتمام و فرنسي، والذي كان من المدهش بالنسبة للفرنسيين أنه تحدث جيدًا. على الرغم من حقيقة أنه في نفس اليوم، كان بيير مرتبطا بالمشتبه بهم الآخرين الذين تم القبض عليهم، لأن الضابط يحتاج إلى غرفة منفصلة يشغلها.
كل الروس الذين أبقوا مع بيير كانوا أشخاصًا من أدنى رتبة. وكلهم، الذين اعترفوا بالرجل النبيل في بيير، تجنبوه، خاصة أنه يتحدث الفرنسية. سمع بيير بحزن السخرية من نفسه.
في اليوم التالي، في المساء، علم بيير أن جميع هؤلاء المعتقلين (وربما، بما في ذلك هو نفسه) سيحاكمون بتهمة الحرق العمد. في اليوم الثالث، تم نقل بيير مع آخرين إلى منزل كان يجلس فيه جنرال فرنسي ذو شارب أبيض وعقيدان وفرنسيون آخرون يرتدون الأوشحة على أيديهم. تم طرح أسئلة على بيير وآخرين حول هويته التي يُزعم أنها تتجاوز نقاط الضعف البشرية والدقة والتصميم التي يتم التعامل بها عادةً مع المتهمين. اين كان هو؟ لأي سبب؟ وما إلى ذلك وهلم جرا.
هذه الأسئلة، مع ترك جوهر المسألة الحياتية جانبًا واستبعاد إمكانية الكشف عن هذا الجوهر، مثل جميع الأسئلة المطروحة في المحاكم، كان هدفها فقط إنشاء الأخدود الذي أراد القضاة أن تتدفق عبره إجابات المدعى عليه وتقوده إلى الهدف المنشود، وهو الاتهام. بمجرد أن بدأ يقول شيئًا لا يرضي غرض الاتهام، اتخذوا أخدودًا، ويمكن للمياه أن تتدفق أينما أرادت. بالإضافة إلى ذلك، عانى بيير من نفس الشيء الذي يعيشه المتهم في جميع المحاكم: الحيرة من سبب طرح كل هذه الأسئلة عليه. لقد شعر أن خدعة إدخال الأخدود هذه لم تستخدم إلا من باب التنازل أو من باب المجاملة. كان يعلم أنه تحت سلطة هؤلاء الأشخاص، وأن القوة الوحيدة هي التي أتت به إلى هنا، وأن القوة الوحيدة هي التي أعطتهم الحق في المطالبة بإجابات على الأسئلة، وأن الغرض الوحيد من هذا الاجتماع هو اتهامه. ولذلك، إذ كانت هناك قوة، وكانت هناك رغبة في الاتهام، لم تكن هناك حاجة إلى خدعة الأسئلة والمحاكمة. كان من الواضح أن كل الإجابات يجب أن تؤدي إلى الشعور بالذنب. عندما سئل عما كان يفعله عندما أخذوه، أجاب بيير ببعض المأساة أنه كان يحمل طفلاً إلى والديه، qu"il avait sauve des flammes [الذي أنقذه من النيران]. - لماذا قاتل مع اللص أجاب بيير أنه كان يدافع عن امرأة، وأن حماية المرأة المهينة واجب على كل شخص، أنه... تم إيقافه: هذا لم يذهب إلى هذه النقطة لماذا كان في باحة منزل مشتعل أين رآه الشهود؟ أجاب أنه كان سيشاهد ما يحدث في موسكو. أوقفوه مرة أخرى: لم يسألوه إلى أين هو ذاهب، ولماذا كان بالقرب من النار؟ من هو؟ كرروا السؤال الأول له، الذي قال إنه لا يريد الإجابة عليه، وأجاب مرة أخرى أنه لا يستطيع أن يقول ذلك.